NEWS
新闻资讯
|
文献解读 | meRIP-seq+ChIP-seq助力首次揭示RNA m5C修饰与组蛋白修饰间相互关系及其功能
2022年11月16日,中国农业科学院生物技术研究所普莉团队在Advanced Science在线发表了题为“RNA 5-Methylcytosine Modification Regulates Vegetative Development Associated with H3K27 Trimethylation in Arabidopsis” 的研究论文。 该研究作者通过m5C meRIP-seq、RNA-seq、ChIP-seq、LC-MS/MS等技术,发现EMF1通过多种表观遗传修饰来调控基因表达,从而调节拟南芥的营养发育,揭示了一种涉及组蛋白修饰和RNA m5C甲基化的新表观遗传机制,从而为真核生物的基因调控研究提供了新的方向。 研究背景 研究材料 WT、LFY::asEMF1、emf1突变体 技术路线
研究结果 1. 拟南芥中emf1功能的丧失导致叶绿体发育缺陷和光合作用受损以及淀粉的大量积累 功能缺失的emf1突变体在萌发时开花,产生矮杆植物。除了发育缺陷外,emf1突变体为黄色或浅绿色,而野生型(WT)植物为深绿色(图1A)。转基因 LFY::asEMF1植株表现出弱表型,产生带有几个同样为浅绿色的营养叶的小芽(图1A)。此外,作者发现LFY::asEMF1和emf1突变体中的总叶绿素、类胡萝卜素以及叶绿素a/b水平明显低于WT(图1B)。 emf1突变体的叶片呈淡绿色,光合效率降低,表明叶绿体发育不良。通过透射电镜(TEM)对WT、emf1和LFY::asEMF1植株的叶绿体超微结构进行观察。结果表明,WT幼苗子叶、下胚轴和真叶的叶绿体呈新月形,类囊体系统形态良好,而emf1突变体和LFY::asEMF1植株的类囊体层片状层数减少,颗粒排列不整齐。有趣的是,作者发现LFY::asEMF1和emf1突变体积累的颗粒更大、数量更多,表明突变体幼苗积累了更多的淀粉(图1C)。然而,作者发现emf1突变体的光合能力受损并没有减少淀粉颗粒,这表明淀粉颗粒的增加可能不依赖于光或光合作用。此外,作者发现在黑暗条件下,LFY::asEMF1和emf1突变体中的叶绿体仍然充满了淀粉大颗粒(图1C)。综上所述,这些结果表明EMF1促进光合作用并抑制淀粉的产生以促进营养发育。 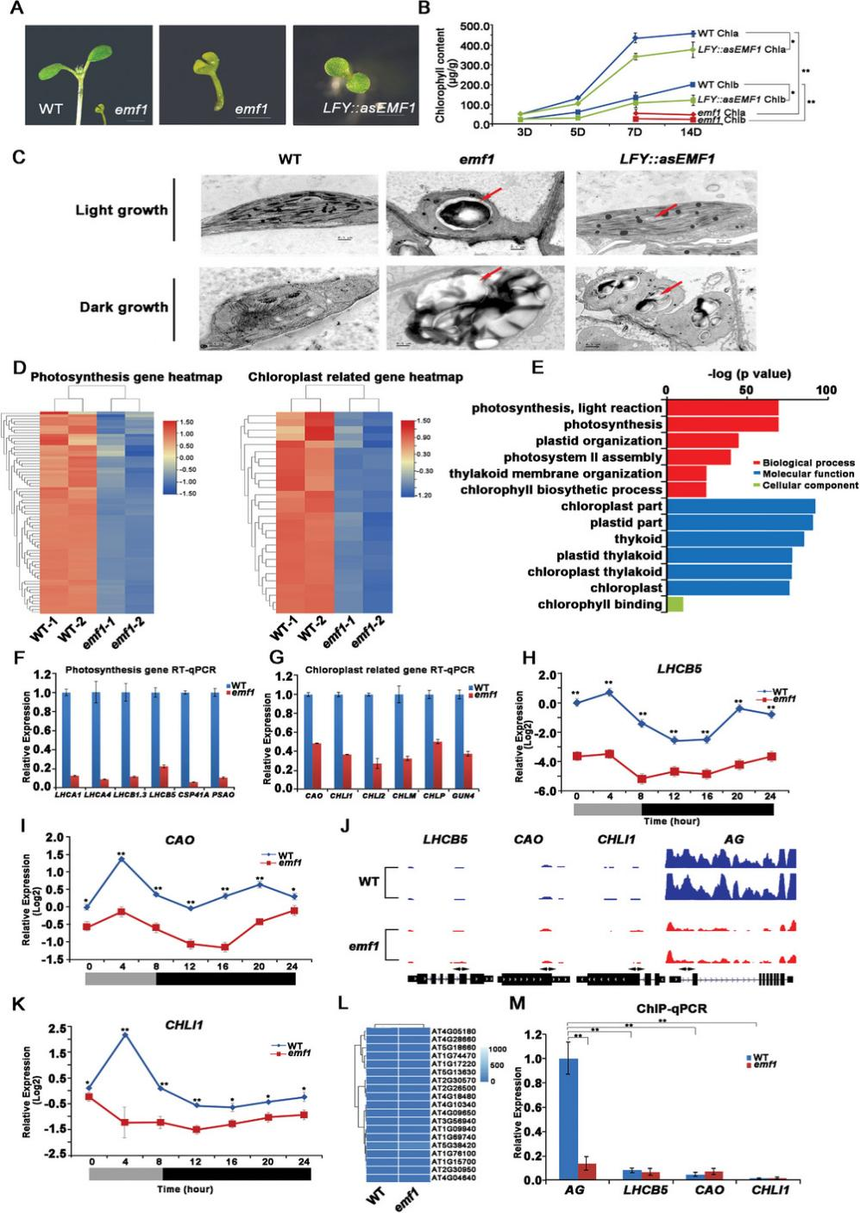 2. Emf1正调控光合作用和叶绿体发育相关基因的表达,这些基因不存在H3K27me3修饰 为了探究EMF1调控光合作用和叶绿体发育的机制,作者首先分析了WT和emf1幼苗的mRNA转录水平,发现当EMF1表达降低时,光合作用和叶绿体发育基因的mRNA水平显著降低(图1D)。GO分析表明,emf1突变体中下调的基因主要富集在光合作用、光反应、光合系统II组装、叶绿素生物合成和叶绿体发育等功能上(图1E), 这与emf1突变体叶绿体发育缺陷、叶绿素含量降低和光合效率低的表型是一致的(图1A,B)。随后,使用RT-qPCR进一步验证了该结果(图1F,G)。此外,作者分析了LHCB5、CAO和CHLI1基因在昼夜周期内的动态表达模式,结果表明emf1突变体中的LHCB5、CAO和CHLI1的转录水平在24 h内远低于WT(图1H,I,K)。总之,EMF1在促进光合作用和叶绿体发育基因表达方面起着至关重要的作用。 已知EMF1在植物中通过H3K27me3修饰参与PcG介导的转录沉默。为了确定光合作用和叶绿体发育基因是否也被H3K27me3标记,作者重新分析了WT和emf1突变体中关于H3K27me3的全基因组ChIP-seq数据。通过AGAMOUS (AG)作为H3K27me3阳性对照,作者发现在WT或emf1突变体中,H3K27me3修饰在光合作用和叶绿体发育相关基因中几乎不存在(图1J、L、M), 这表明EMF1对这些基因的正向调控不涉及H3K27me3修饰。 由于光合作用和叶绿体发育相关基因未发生H3K27me3修饰,说明这些基因的表达不受PcG机制调控,这表明EMF1正向调控的基因中可能存在其他表观遗传标记。据报道,m5C RNA甲基化参与拟南芥的代谢和根系发育以及水稻的光合作用和胁迫反应。为了研究拟南芥中的RNA甲基化是否需要EMF1,作者首先使用m5C抗体对从WT和emf1幼苗进行斑点杂交分析,结果发现,emf1突变体RNA的m5C修饰显著高于WT(图2A)。LC-MS/MS分析证实,emf1突变体在7 day、10 day、14 day时RNA m5C修饰的水平分别提高了50%、50%和42%。同样,LFY::asEMF1植株的m5C水平也高于WT植株(图2B)。这些结果表明,在拟南芥中植物特异性蛋白EMF1参与了m5C修饰。 随后,作者对7 DAG的WT和emf1突变体进行meRIP-seq,分别鉴定出5210和5299个存在m5C RNA修饰的基因,其中二者共有的基因为4755个(89.7%)(图2C)。此外,作者发现emf1突变体中m5C甲基化位点的数量与WT相比没有显著增加(图2D,E)。最终,为了确定获得的peak是否具有共同的序列,作者对peak的motif基序进行了分析(图2G),结果显示,WT中最显著的motif基序是YYTCYYCH和RGARGAR(图2G),而emf1突变体中也存在这些motif。综上所述,EMF1不影响大多数m5C富集的基序。 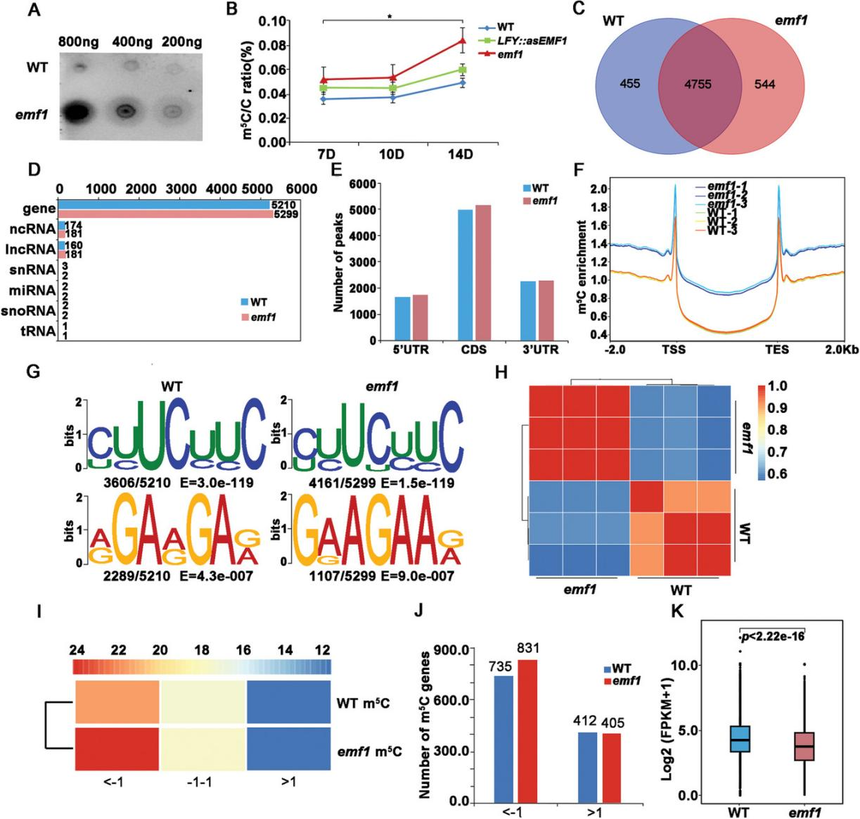 在哺乳动物和植物中,m5C参与mRNA衰变和翻译,但RNA m5C甲基化与转录本丰度之间的关系尚不清楚。为了探究这一问题,作者使用WT和emf1幼苗进行RNA-Seq(图2K),结果显示,与WT相比,emf1突变体中有3526个上调基因和3377个下调基因,还有16931个基因没有变化。基于基因表达量将基因分为上调组、下调组、无变化组,将各组的转录组水平与m5C水平进行比较(图2I,J),结果发现,在emf1突变体中,大量下调基因的m5C位点发生甲基化,但上调基因的m5C水平未发生显著变化,这表明emf1介导的m5C功能特异性地作用于下调基因。此外,m5C甲基化基因在emf1突变体中的表达量显著低于WT(图2K)。 作者发现emf1突变体中淀粉过度积累。为了研究EMF1如何影响淀粉积累,作者分析了淀粉生物合成和降解相关基因的表达量,结果发现大多数淀粉合成基因(73%)在emf1突变体中上调表达(图3B),而淀粉降解基因则均匀上调或下调(图3C)。因此,高度异位表达的淀粉合成基因可能是导致emf1突变体中淀粉积累的原因。据报道,SUS1和SUS3对拟南芥和其他植物物种的淀粉合成很重要。因此,作者选择了这两个基因进行进一步分析。首先通过RT-qPCR验证了SUS1和SUS3在emf1突变体中表达量上调(图3D),随后研究了SUS1和SUS3在WT和emf1植株中24 h的动态表达谱,发现emf1突变体中淀粉的大量积累可能是淀粉合成基因的上调表达引起的。由于EMF1通过H3k27me3参与PcG介导的基因沉默,作者使用先前的ChIP-seq数据分析了WT和emf1突变体中的H3K27me3修饰。结果发现,与WT植物相比,emf1突变体中SUS1和SUS3基因的H3K27me3富集大大降低(图3G),随后通过ChIP-qPCR进一步证实(图3H)。综上所述,这些结果证实了EMF1通过PcG机制维持淀粉生物合成基因的抑制表达状态。  由于EMF1同时介导m5C和H3K27me3,作者进一步探索m5C和H3K27me3修饰是否在表观基因组上相互作用。作者分析了拟南芥全基因组甲基化图谱和H3K27me3的分布(图4A),结果发现在emf1突变体中,H3K27me3修饰在全基因组上的富集程度低于WT,而m5C修饰在全基因组上的富集程度均高于WT。对比m5C和H3K27me3修饰位点的分布,结果表明H3K27me3和m5C在染色体上的分布呈现互补关系,H3K27me3富集的区域缺乏m5C,且有着明显的负相关,反之亦然(图4B)。 随后,作者研究了m5C RNA甲基化和H3K27me3在靶基因调控中的相互作用。结果发现,m5C修饰的光合作用和叶绿体发育相关基因(如LHCB5、CAO、CHLI1)在emf1突变体中的表达量明显降低;而H3K27me3修饰的花基因和淀粉合成基因(如AG、SUS1、SUS3)在emf1突变体中的表达量明显增加(图4C)。这些结果表明,EMF1介导的RNA m5C和H3K27me3修饰分别调控不同的靶基因集。 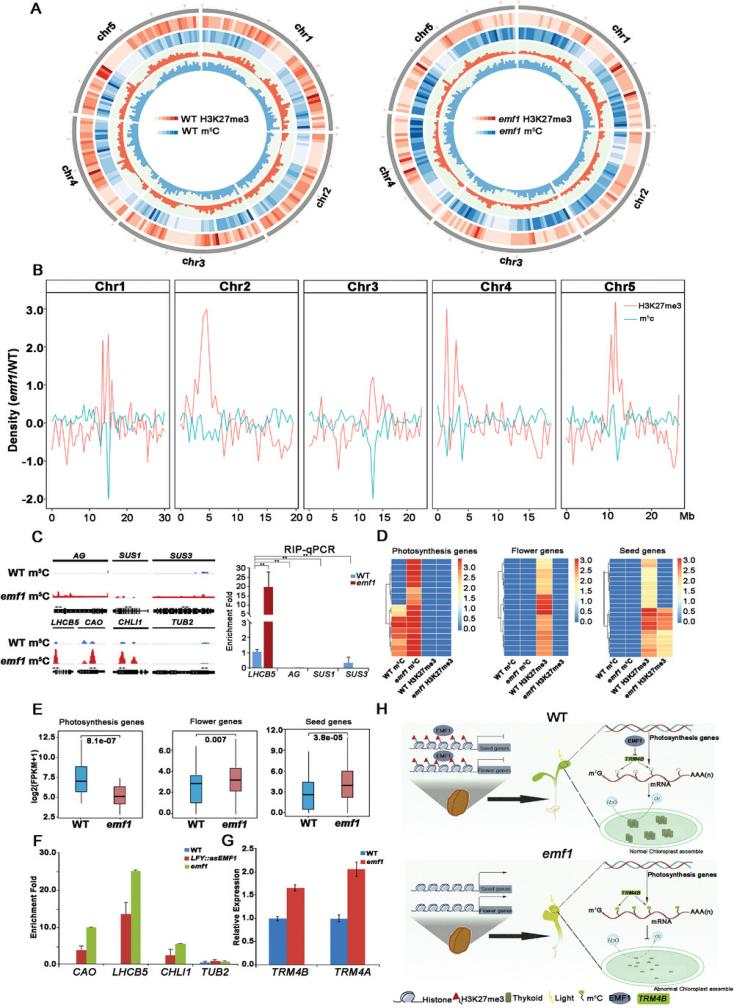 图4 EMF1 是影响染色质状态和转录后RNA m5C修饰和H3K27me3修饰所必需的 7.EMF1通过H3K4me3调控TRM4B的转录,而不依赖于PcG介导的H3K27me3机制 结 论 作者发现植物特异性PcG蛋白EMF1具有双重作用,可作为激活剂或阻抑剂。一方面,EMF1通过抑制m5C甲基转移酶TRM4B表达,从而降低m5C 修饰水平,进一步激活光合作用相关基因的转录水平(图 4H)。另一方面,EMF1通过PcG介导的H3K27me3抑制开花、种子和淀粉合成相关基因(图4H)。基因激活和抑制都是营养发育所必需的。本研究结果揭示了一种新的基因表达调控机制,即植物中组蛋白修饰和 RNA m5C甲基化之间的相互作用。 关于ChIP-seq产品 将染色质免疫共沉淀与第二代测序技术相结合的ChIP-Seq技术,能够高效地在全基因组范围内检测与组蛋白、转录因子等互作的DNA区段。首先通过染色质免疫共沉淀技术(ChIP)特异性地富集目的蛋白结合的DNA片段,并对其进行纯化与文库构建;然后对富集得到的DNA片段进行高通量测序。研究人员通过将获得的数百万条序列标签精确定位到基因组上,从而获得全基因组范围内与组蛋白、转录因子等互作的DNA区段信息。
ChIP-seq项目经验
爱基百客在meRIP-seq、ChIP-seq上拥有丰富的项目经验,提供从方案设计-测序-分析的一站式服务。有相关需求的老师欢迎联系我们。 |