NEWS
新闻资讯
|
T细胞耗竭如何研究,看看这篇靶向甲基转移酶的癌症顶刊思路 | 国自然热点
T 细胞耗竭(T Cell Exhaustion, Tex)是指因长期慢性感染或癌症,导致患者体内T细胞功能丧失的情况。由于长期暴露于持续性抗原或慢性炎症,T细胞逐渐失去效应功能,记忆T细胞特征也开始缺失。T细胞耗竭通常与对持续感染和肿瘤的控制效率低下有关,但激活耗竭的T细胞可以重新激活免疫力[1]。 研究发现阻断免疫检查点PD-1可以部分恢复恢复耗竭的T细胞活力,但并不能部分恢复全部T细胞或不能恢复耗竭的T细胞的全部活力。此外,同时阻断多个免疫检查点,如PD-1和TIM-3等,可大幅度恢复耗竭T细胞的活性,这一思路成为目前癌症免疫治疗的重要策略之一。2021年,斯坦福大学医学院在Science发表CAR-T细胞的研究文章,在该研究中用到一种名叫达沙替尼(一种FDA批准的酪氨酸激酶抑制剂,能可逆地抑制CAR近端信号)的药物,通过该药物可以使T细胞短暂休息,能够逆转CAR-T细胞的耗竭表型,重振CAR-T细胞活力,从而使其表现出更持久的抗肿瘤能力[2]。
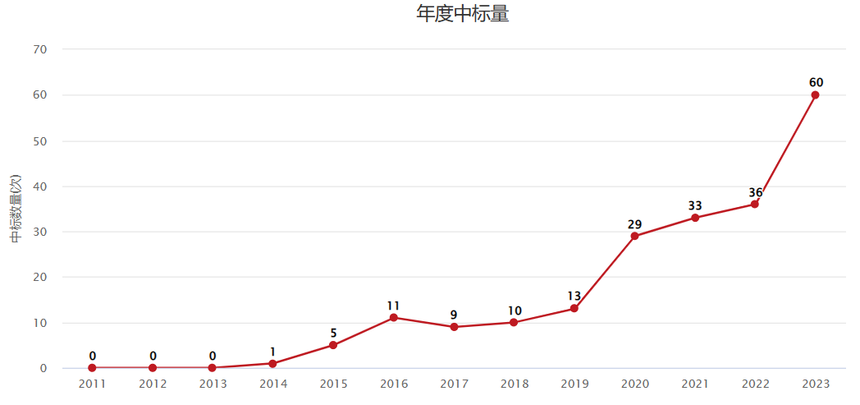
国自然中标量 免疫调控近些年一直是国自然的热点方向,其中T细胞耗竭在2023年国自然中标量中增幅较大。这个方向向来备受医学顶级期刊青睐,既是科研热点方向,又极具临床转化价值。今天我们分享一篇以“CAR-T细胞”和“甲基转移酶SUV39H1”为切入点的癌症顶刊论文,帮大家提供一些思路。 2023年科学突破奖和引文桂冠奖都授予了在CAR-T细胞疗法中有开创性工作的Carl June 教授和Michel Sadelain教授,而Michel Sadelain教授团队在2023年11月在期刊Cancer Disvcov(IF=29.1)发表了名为《Disruption of SUV39H1-Mediated H3K9 Methylation Sustains CAR T-cell Function》的研究论文。这篇研究的主要内容是关于SUV39H1基因的编辑对CAR-T细胞功能的影响。研究发现,SUV39H1基因的编辑可以改善CAR-T细胞的代谢适应性和功能,通过改善CAR-T细胞的增殖、持久性和限制衰竭的发生来增强它们的抗肿瘤疗效。研究使用多种技术手段,包括CAR-T细胞注射后的肿瘤成像、代谢分析、单细胞RNA测序和ATAC-seq等,以评估CAR-T细胞的功能和特性。
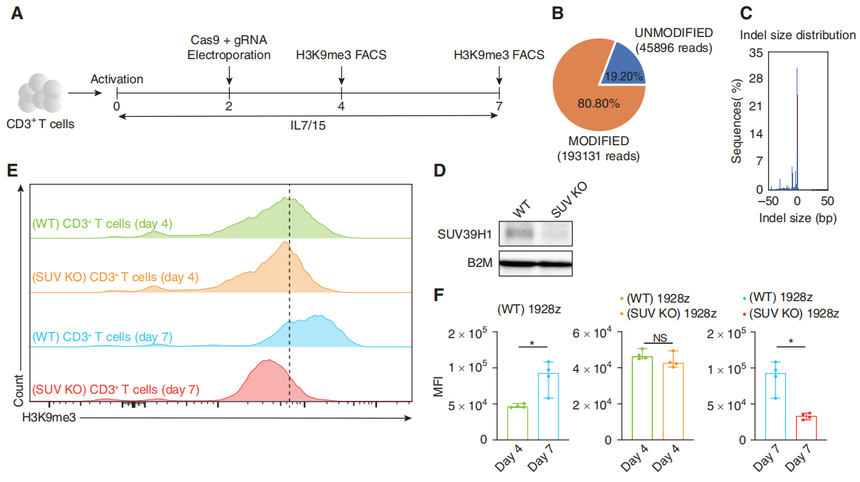
我们以5个问题来看看这篇研究如何开展的。 CAR-T细胞疗法是一种免疫疗法,它利用患者自身的T细胞,通过基因工程技术改造成能够识别和攻击癌细胞的CAR-T细胞。其基本原理是,通过提取患者的T细胞,然后在实验室中利用基因工程技术将CAR(嵌合抗原受体)基因导入到T细胞中,使其具有识别和攻击癌细胞的能力。经过体外扩增后,这些CAR-T细胞被重新注入患者体内,以帮助患者的免疫系统更有效地识别和摧毁癌细胞。CAR-T细胞疗法已经在治疗一些特定类型的白血病和淋巴瘤等血液系统肿瘤方面取得了显著的成果,具有很高的疗效。随着技术的不断进步,CAR-T细胞疗法也在不断扩展到其他类型的癌症治疗领域。 但是,仍有相当一部分患者在CAR治疗有反应后最终会复发。其中,T细胞耗竭是因素之一。小鼠模型和临床试验的一些案例表明CAR-T细胞的持久性不足和功能障碍与肿瘤复发有关[2-5]。在CAR-T细胞中,DNA甲基化调节因子DNMT3a和TET2的破坏可以改善记忆的形成,并被认为可以增强抗肿瘤疗效。 H3K9me3是真核细胞内最重要的抑制性组蛋白修饰,其可以抑制基因组内广泛存在的重复序列和维持基因组稳定性。它有三个主要的催化蛋白:SUV39H1、SUV39H2和SETDB1。研究团队聚焦SUV39H1基因,文献报道显示它可以控制小鼠中Th2效应器的谱系决定,在急性单核细胞增多性李斯特菌感染模型中可以控制小鼠CD8+ T细胞的记忆到效应的转变。基于文献,增强基于CD28的CARs的功能持久性可能改善临床结果。于是,他们做了假设:破坏SUV39H1可能会提高人基于CD28的CAR-T细胞的功能持久性和抗肿瘤疗效。 作者首先使用CRISPR/Cas9技术敲除T细胞的SUV39H1基因,然后使用western blot、流式细胞术技术确定H3K9me3水平在几天内会整体下降。
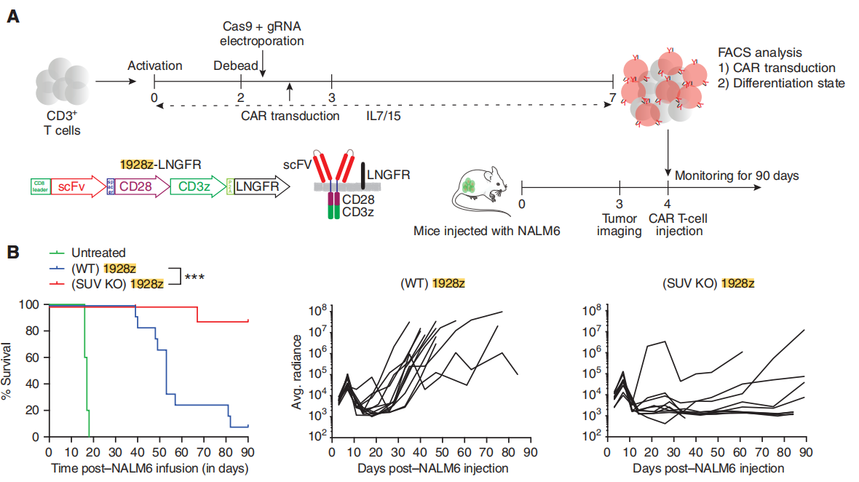
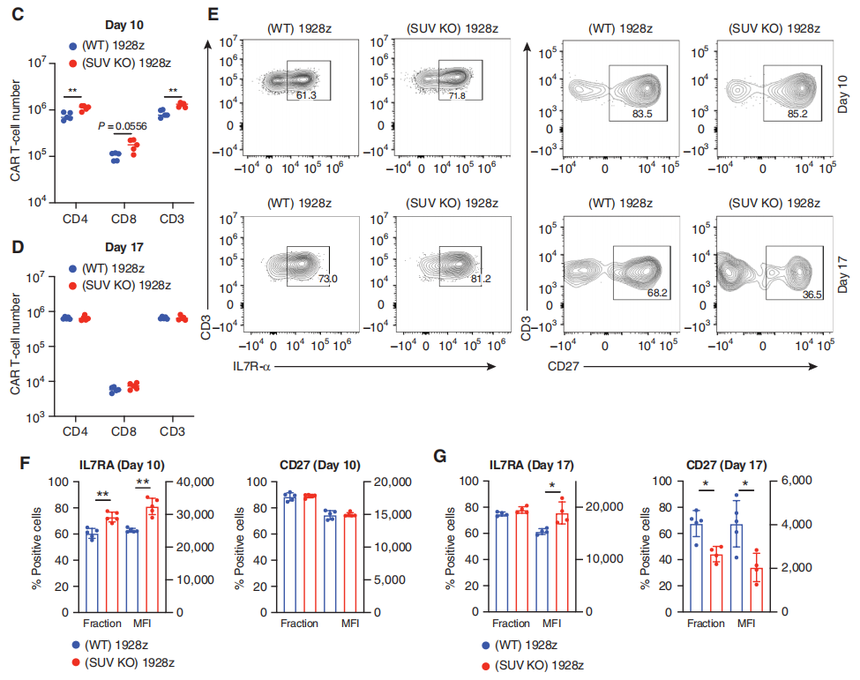
图1:SUV39H1的破坏降低了T细胞中H3K9me3的整体水平。 然后,为了评估SUV39H1破坏对CAR-T细胞的抗肿瘤疗效的影响,研究团队使用低剂量的SUV39H1-编辑或未编辑的CAR-T细胞治疗携带人B细胞急性淋巴细胞白血病(B-ALL)的NSG小鼠NALM6。小鼠存活实验表明SUV39H1编辑增强了1928zCAR-T细胞的抗肿瘤疗效,10个NALM6携带小鼠使用SUV39H1编辑的CAR-T细胞治疗有9个存活了超过90天的观察期(这一组小鼠被命名SUV KO 1928z),与之对照的未编辑的CAR-T细胞治疗的小鼠(被命名为野生型WT 1928z)12个中有1个存活。 研究团队还将NALM6设计用来表达GFP-荧光素酶来监测小鼠的肿瘤负荷。团队在WT 1928z和SUV KO 1928z CAR-T细胞中注意到非常相似的原发性肿瘤清除动力学(CAR-T细胞注射后的前10天)。然而,与SUV KO1928z CAR-T细胞治疗的小鼠相比,WT 1928z CAR-T细胞处理的小鼠在最初的肿瘤清除后复发,SUV KO1928z CAR-T细胞治疗的小鼠保持了持久的肿瘤控制(图2B)。
图2:SUV39H1破坏增强CAR-T细胞的抗肿瘤疗效 研究团队使用流式细胞仪测量了肿瘤清除后早期(CAR-t细胞输注后第10天)和一周后(输注后第17天)骨髓(疾病原发性部位)中的CAR-T细胞数量。SUV39H1编辑增强了第10天的CAR-T细胞数量(图2C),但没有增强第17天的CAR-T细胞数量(图2D)。研究团队在第10天观察到SUV KO CAR-T细胞中IL7Rα(记忆T细胞亚群的标记物)的表达增加(图2E和F)。在第17天,他们还观察到IL7Rα的表达增加(平均荧光强度,图2E和G)。另外,研究团队还观察了CD27和PD-1的表达。这部分的结果显示SUV39H1的破坏促进了早期CAR-T细胞的扩张,在低剂量CAR-T细胞治疗的白血病小鼠中,增加IL7R的表达,同时降低CD27和PD-1的表达。
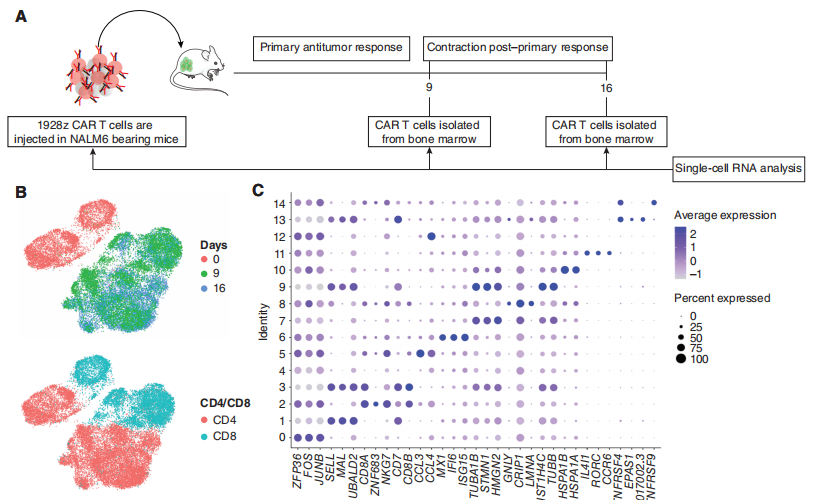
图2:SUV39H1破坏增强CAR-T细胞的抗肿瘤疗效 此外,为了确定gRNA的脱靶效应是否有助于增强CAR-T细胞的功能,研究团队确定了在CAR刺激前和4轮CAR刺激后,SUV39H1位点和前10个预测脱靶(OT)位点的编辑效率。SUV39H1 gRNA的脱靶活性较低,且脱靶编辑不会随着时间的推移而富集。 为了评估SUV39H1的破坏能否延伸到增强其他CAR设计的有效性。研究团队使用前列腺癌模型,在该模型中测试了3个不同CAR设计(PSMA28z,PSMA28z-1xx,PSMABBz)。SUV39H1的破坏增强了所有3种CAR设计的抗肿瘤疗效。这些结果表明,SUV39H1破坏可能作为改善CAR-T细胞功能的一般策略。 针对这个问题,研究团队对SUV KO 1928z CAR-T细胞和WT 1928z CAR-T细胞进行了连续的单细胞转录分析,以表征随着时间的推移,SUV39H1破坏对1928z CAR-T细胞的影响(图3A)。实验设计上,研究团队选取3个时间点进行单细胞测序分析:输注前(day 0)、输注后第9天(Day9)和第16天(Day16)。文章中作者对实验设计的时间点,进行了解释:第0天提供了未编辑组和SUV39H1编辑组的基线基因表达谱。第9天对应于初级抗肿瘤反应的峰值,第16天对应于初级反应后的收缩。在这两种基因型和所有三个时间点上,共鉴定了15个亚群(图3B和C)。
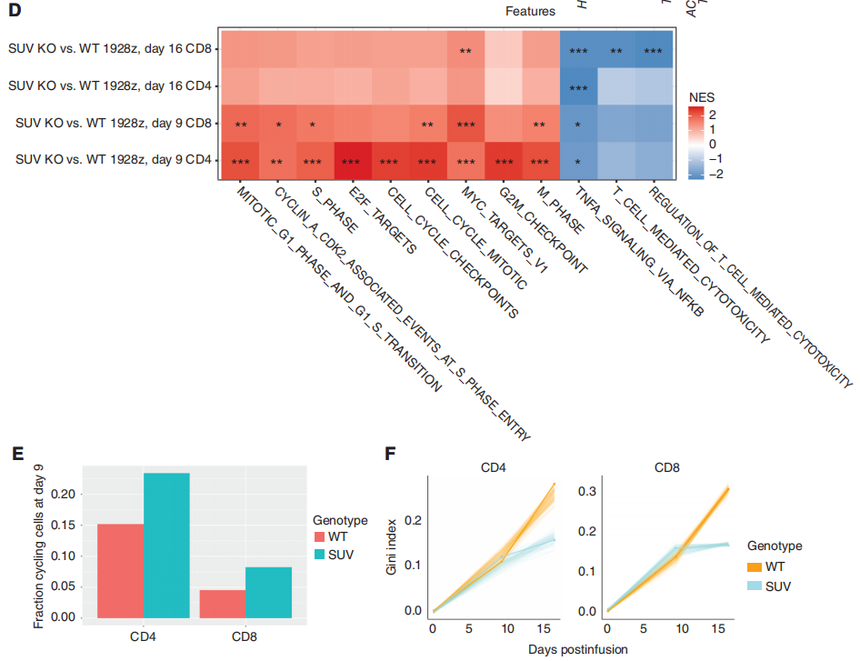
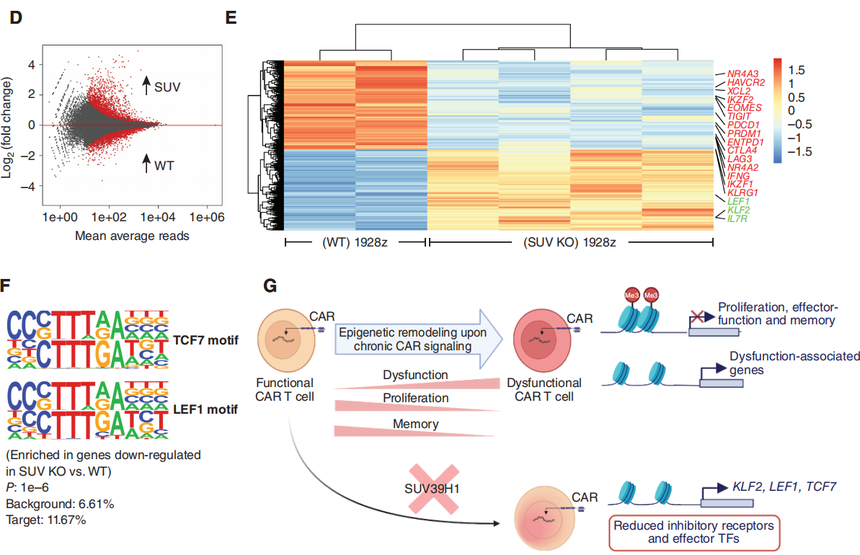
图3:CAR-T细胞的单细胞转录谱分析。 GSEA分析表明,SUV39H1编辑的1928zCAR-T细胞增殖增加,效应功能降低(图3D)。在第9天,研究团队观察到在SUV39H1编辑的1928z CAR-T细胞中增殖途径的富集,这与CD4和CD8循环细胞的相对丰度增加有关(图3E)。然后,研究对差异基因进行了分析,作者分析了“细胞骨架调控”和“效应器功能”相关的基因以及“与记忆相关”的转录因子和受体。其中,在SUV39H1编辑的1928z CAR-T细胞中,与记忆相关的转录因子和受体(KLF2、LEF1、TCF7、SELL)在第16天升高,但在第9天没有升高。前体耗竭T细胞(Tpex)表达记忆转录因子,如TCF7,保留了一些增殖和效应功能。然而,在第16天,作者并没有在WT和SUVKO 1928z CAR-T细胞中发现这个明显的比例。与效应T细胞相比,记忆T细胞具有更好的增殖能力和持续生存能力。 研究团队假设SUV KO 1928z CAR-T细胞中记忆因子的持续表达会随着时间的推移,促进更大的克隆多样性。因此,基于这三个时间点的单细胞测序数据,研究团队评估了T细胞受体(TCR)vβ序列的多样性,这里它引入了一个基尼指数(Gini index)来评估,低基尼指数表明存在高度的受体多样性。与预期的一样,TCRvβ序列的总体多样性从第0天下降到第16天(图3F)。然而,虽然WT和SUV KO 1928z CAR-T细胞在最早的时间点相似,但两组在第16天分化,在SUV39h1编辑组CD4和CD8 T细胞均表现出更大的多样性(图3F)。总的来说,单细胞转录谱分析表明,人类CAR-T细胞中SUV39H1的破坏促进了增殖和记忆程序,抑制了效应程序,并维持了更广泛的克隆库。
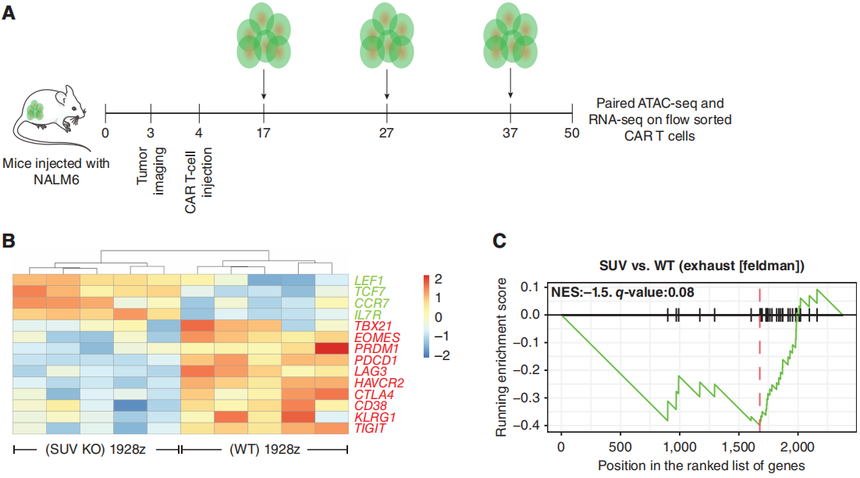
图3:CAR-T细胞的单细胞转录谱分析。 转录谱分析显示,与SUV KO CAR-T细胞相比,WT CAR-T细胞中细胞毒性和细胞因子信号通路富集。于是,研究团队测量了细胞因子的分泌情况,检测了细胞因子(IL2、TNF、IFNγ)和颗粒酶B(GZMB)的含量,会适度减弱它们的分泌。据文献报道,T细胞中的强效应分化最终导致与代谢健康不良相关的功能失调状态。研究选择了耗氧率(OCR)和细胞外酸化率(ECAR)作为测量指标。综合这些观察结果表明,SUV39H1的破坏可以抑制细胞因子的分泌,并促进CAR-T细胞的线粒体适应度。基于这些研究结果,研究团队也评估了随时间的慢性激活下的细胞溶解功能,结果显示SUV39H1的破坏,维持了1928zCAR-T细胞的细胞溶解功能。 为了更好地理解SUV39H1的破坏对CAR-T细胞的影响,研究团队分析了重复挑战下的转录和染色质可及性分析。转录分析显示与野生型的1928z CAR-T细胞相比,SUV KO 1928z CAR-T细胞中的与记忆相关的转录因子和受体,如TCF7、LEF1、CCR7和IL7R表达增加(图4B)。另一方面,WT 1928z CAR-T细胞表达的效应/末端效应状态相关转录因子如TBX21、EOMES和PRDM1表达水平增加。在WT 1928z CAR-T细胞中,观察到各种抑制性受体如PDCD1、LAG3、HAVCR2、CTLA4、CD38、KLRG1和TIGIT的表达增加(图4B)。GSEA显示,在WT 1928z CAR-T细胞中,人T细胞衰竭相关基因的富集增加(图4C)。
图4:SUV39H1的破坏允许记忆转录因子(TF)的持续表达,并限制了末端效应转录因子和抑制性受体的表达 研究团队利用ATAC-seq分析可及性,与WT1928zCAR-T细胞相比,SUV KO 1928z CAR-T细胞的整体可及性增加,这与SUV39H1在介导H3K9甲基化和维持异染色质结构中的作用相一致(图4D)。虽然突变体整体染色质可及性增加,但是研究观察到编辑CAR-T细胞中几种抑制受体和效应/末端效应状态相关转录因子的染色质可及性降低。对SUV KO 1928z CAR-T细胞中下调基因的motif进行分析,存在TCF7(蛋白TCF1)/LEF1基序的富集。这部分研究结果表明在反复暴露于肿瘤后,SUV39H1编辑的1928zCAR-T细胞将保持对已知的促进T细胞记忆和功能的位点的可及性。在1928z CAR-T细胞中,SUV39H1的编辑也降低了效应转录因子和抑制受体的位点可及性和表达。
图4:SUV39H1的破坏允许记忆转录因子(TF)的持续表达,并限制了末端效应转录因子和抑制性受体的表达 该研究发现SUV39H1编辑通过改善CAR-T细胞的增殖、持久性和限制衰竭的发生来增强它们的抗肿瘤疗效。这些特征与记忆转录因子的持续表达有关,特别是TCF7和LEF1。总的研究结果表明,破坏SUV39H1和潜在的其他组蛋白甲基转移酶是一种很有前途的策略,可以平衡CAR传递给人类T细胞的效应功能和持久性。 延伸的说一下,作者文中提及的“破坏SUV39H1和潜在的其他组蛋白甲基转移酶是一种很有前途的策略”。2024年1月来巴黎文理研究大学的研究团队在Cancer Discov发表题为“SUV39H1 Ablation Enhances Long-term CAR T Function in Solid Tumors”的研究论文。该研究同样以“SUV39H1”为靶点,通过单细胞转录组和单细胞ATAC-seq等技术发现SUV39H1对H3K9甲基化的表观遗传调控,优化了BBz-CAR T细胞的长期功能持久性,限制了复发,并提供了对肿瘤再次挑战的保护。 表观遗传调控越来越多的受到科研和临床研究的重视,爱基百客作为提供领先的表观组学技术服务的公司,在组蛋白修饰调控蛋白上有丰富的项目经验,可以提供ChIP-seq、CUT&Tag、ATAC-seq以及单细胞转录组和单细胞表观组学(scATAC-seq,scChIP-seq)等技术服务,欢迎各位老师咨询。此外,我们也针对T细胞耗竭方向提供了一个可行性方案,感兴趣的老师可以联系销售获取~
项目咨询
1. Wherry, E.J. and M. Kurachi, Molecular and cellular insights into T cell exhaustion. Nature Reviews Immunology, 2015. 15(8): p. 486-499. 2. Weber, E.W., et al., Transient rest restores functionality in exhausted CAR-T cells through epigenetic remodeling. Science, 2021. 372(6537). 3. Terence, P.E., et al., Targeted elimination of prostate cancer by genetically directed human T lymphocytes. Cancer Res, 2005.65:9080-8. 4. Turtle, C.J., et al., CD19 CAR-T cells of defined CD4+:CD8+ composition in adult B cell all patients. J Clin Invest, 2016.126:2123-38. 5. Maude, S.L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. N Engl J Med. 2014,371:1507-17. 了 解 更 多 { 往 期 精 彩 回 顾 } 精选合集,欢迎收藏哟! |