NEWS
新闻资讯
|
客户文章 | 王牌产品ChIP-seq又一高分文章(IF>15),基底样乳腺癌新的诊断候选标记物和治疗靶点的发现
发表单位:昆明动物研究所 发表日期:2022年1月13日 期 刊:Cell Death Differ(IF:15.828) 2022年1月13日昆明动物研究所陈策实研究团队在期刊Cell Death & Differentiation(IF:15.828)发表了题为“YB-1 is a positive regulator of KLF5 transcription factor in basal-like breast cancer”的研究论文。该研究结果表明Y-box结合蛋白1(YB-1)在不同水平上正调控KLF5转录因子,促进基底样乳腺癌的进程。新的RSK2-YB-1-KLF5-KRT16/Ly6D轴为基底样乳腺癌提供了诊断候选标记物和治疗靶点。爱基百客为该研究提供ChIP-seq和RNA-seq的技术支持。
研究背景 Y-box结合蛋白1 (YB-1)是一种在多种癌症(包括基底样乳腺癌BLBC)中高度表达的知名致癌基因。除了作为转录因子的作用,它被新定义为涉及RNA 5-甲基胞嘧啶的表观调节子。然而,它的具体靶点和促癌功能尚不明确。乳腺癌中KLF5的高水平表达与患者低生存率有关,但其在乳腺癌中特异高表达的机制尚不清楚。 研究思路
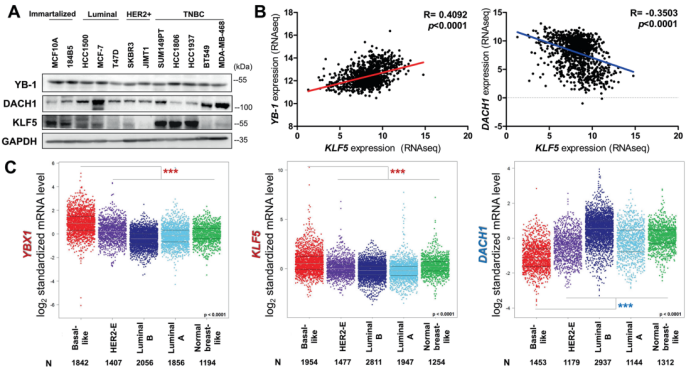
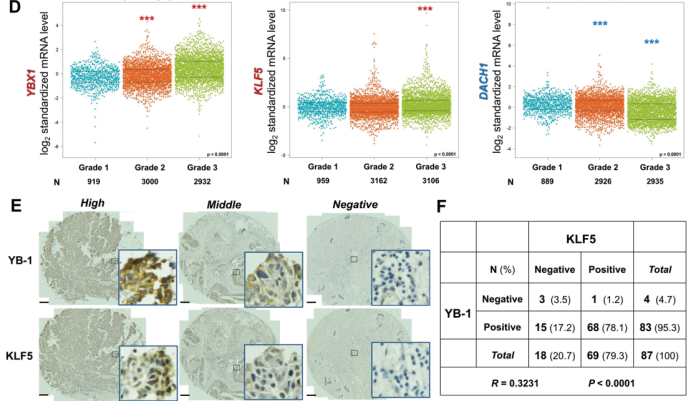
研究结果 1. 乳腺癌中KLF5表达与YB-1表达呈正相关,与DACH1表达呈负相关 Dachshund同系物1(DACH1)是一种众所周知的肿瘤抑制因子,可以抑制致癌基因(比如YB-1)的转录。近期研究显示DACH1可抑制YB-1介导的KLF4(KLF5的家族成员)调控。作者首先试图弄清楚BLBCs中YB-1、DACH1和 KLF5的关系。利用Western blotting共表达、癌症基因组图谱数据库(TCGA)、免疫组化等技术分析,结果显示临床上乳腺癌中YB-1与KLF5表达呈正相关,而DACH1与KLF5表达呈负相关。
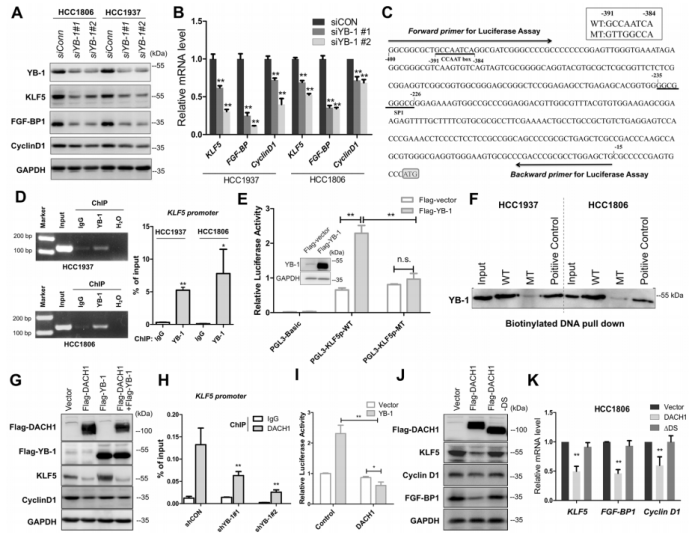
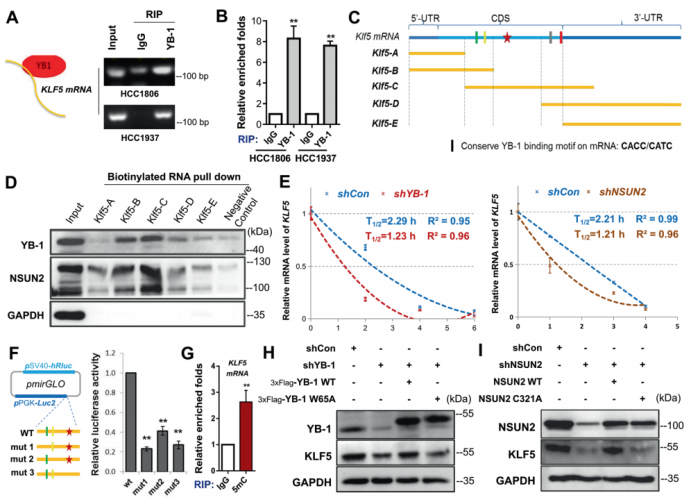
图1. 在乳腺癌中KLF5表达与YB-1呈正相关,与DACH1呈负相关。 2. 在BLBC细胞中YB-1和DACH1协调KLF5的转录 作者接着研究了YB-1和DACH1是否调控KLF5的表达。在两个细胞系(基底样乳腺癌细胞系HCC1937和HCC1806)中敲除YB-1,KLF5和其下游靶点(CyclinD1和FGF-BP1)的蛋白水平和mRNA表达水平明显减少(图2.A和B)。在KLF5近端启动子中鉴定到了一个预测的YB-1结合位点(从KLF5起始密码子ATG处−391到−384)(图2.C)。然后,作者进行了染色质免疫共沉淀(ChIP),发现YB-1的抗体特异地沉淀下来KLF5预测的启动子片段(图2.D)。荧光素酶报告实验和体外oligo pull-down实验也用来证明它们的转录调控关系。以上这些结果都显示YB-1通过直接结合KLF5启动子CCAAT box来促进KLF5的转录。 作者进一步检测了DACH1是否抑制YB-1和KLF5的表达。超表达和敲除DACH1后观察蛋白表达情况证实了它确实影响YB-1和KLF5的表达。另外,作者发现一个有趣的结果:敲除YB-1显著减少DACH1与KLF5启动子的结合,故DACH1是以依赖YB-1的方式结合KLF5启动子(图2. H)。作者也证实了DACH1抑制KLF5和其下游靶基因的表达(图2.J和K)。以上结果显示YB-1是KLF5的正向调节子,而DACH1抑制依赖YB-1的KLF5转录。
图2. YB-1和DACH1共同调控KLF5的转录 3. 在BLBC细胞中YB-1结合并稳定m5C修饰的KLF5 mRNA 在各种癌症中,YB-1是一种致癌的RNA结合蛋白。作者调查YB-1是否结合KLF5的mRNA。利用RIP(RNA免疫共沉淀)技术,在HCC1806和HCC1937细胞中YB-1抗体强力地沉淀KLF5的mRNA(图3.A和B)。以往研究的RNA-m5C测序结果报道了膀胱癌中KLF5 mRNA的一个潜在YB-1结合位点。因此,作者分别对这个位点和第一个/二个位点进行突变(C变A),他们发现任何一种突变都减少融合转录本的稳定性(图3.F)。作者然后证明了5mC-RIP富集KLF5转录本(图3.G),这意味着KLF5的mRNA受到m5C的修饰。
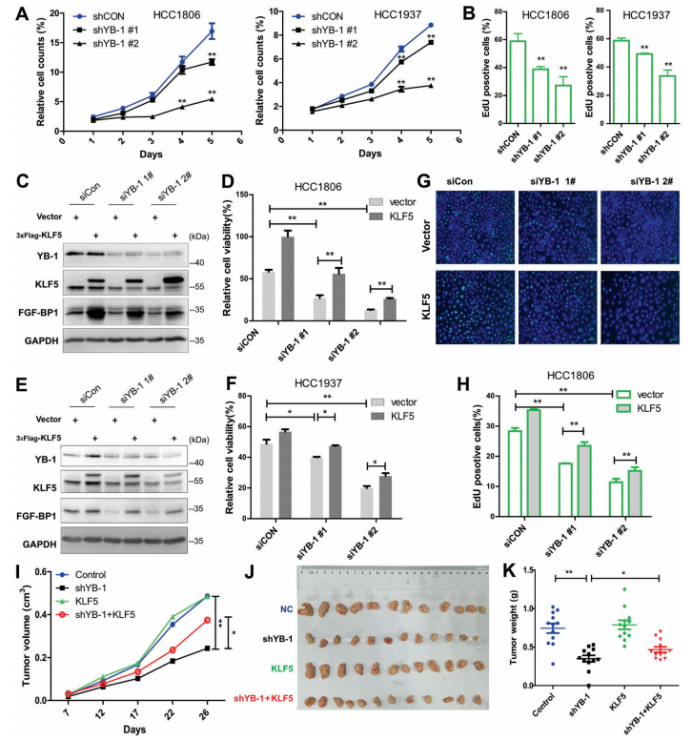
图3. YB-1结合并稳定乳腺癌细胞中m5c修饰的KLF5 mRNA 4. YB-1通过KLF部分地促进BLBC细胞增殖和肿瘤生长 作者想知道YB-1是否通过KLF5促进BLBC细胞增殖。结果如预期,YB-1的缺失显著减少了细胞生长和DNA合成(图4.A和B);在HCC1806和HCC1937细胞中超表达DACH1也抑制细胞生长和DNA合成。此外,超表达KLF5显著地挽救了由YB-1缺失诱导的FGF-BP1蛋白表达、细胞活力和DNA合成减少的情况(图4.C-H)。YB-1缺失的癌症细胞与正常细胞相比生长速度明显减慢(图4.F),YB-1敲除的异种移植肿瘤重量显著低于对照组(图4.H)。在YB-1敲除的细胞中超表达KLF5,YB-1缺失诱导的肿瘤生长抑制效应被部分但显著地挽救(图4.G和H)。综上所述,YB-1通过刺激KLF5的表达部分地促进BLBC的细胞增殖和肿瘤生成。
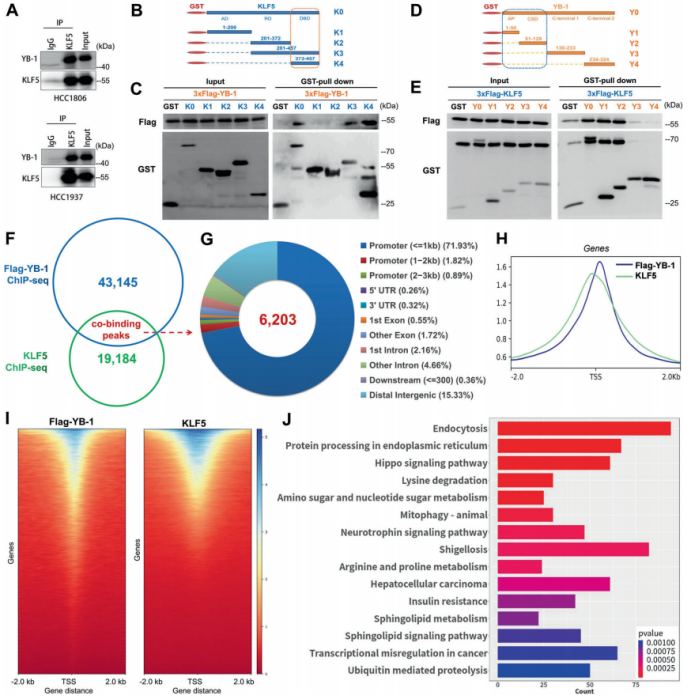
图4. YB-1部分通过KLF5促进BLBC细胞增殖和肿瘤生长 5. YB-1和KLF5共调控BLBC细胞基因转录 值得注意的是,KLF5超表达并不能完全拯救YB-1耗尽诱导的细胞生长停滞。作者推测YB-1可能在蛋白水平上与KLF5互作。为了验证推测,作者首先做了Co-IP实验并验证了YB-1和KLF5的互作(图5.A)。作者进一步详细地描绘了他们之间的互作,并且证实KLF5 C端的三个锌指结构域都参与了互作(图5.B和C)。YB-1的AP(Ala/Pro-rich N-terminal)结构域和CSD(cold-shock domain)结构域负责与KLF5互作(图5.D和E)。 为了在全基因组范围内描绘YB-1和KLF5的共结合景观,作者在HCC1806细胞中进行Flag-YB-1和KLF5的ChIP-seq分析。汇流性分析显示YB-1和KLF5包含6203个共结合位点/区域(图5.F),共结合位点的无偏鉴定显示一个主要的GC富集motif。大部分位点/区域(~75%)位于转录起始元件,包括启动子、5’-UTR和第一个外显子,其次是远端基因组区域(15.33%)(图5.G)。在YB-1和KLF5中可以观察到结合轨迹和类似空间分布模式之间更紧密的空间距离(图5.H和I)。此外,KEGG/GO分析结果暗示这些共结合基因涉及细胞生长和存活、细胞代谢以及癌症中转录失调的功能(图5.J)。总的来说,作者证明了YB-1和KLF5可能在一个转录复合体中相互作用,去共同调控一组参与乳腺癌细胞生长的基因。
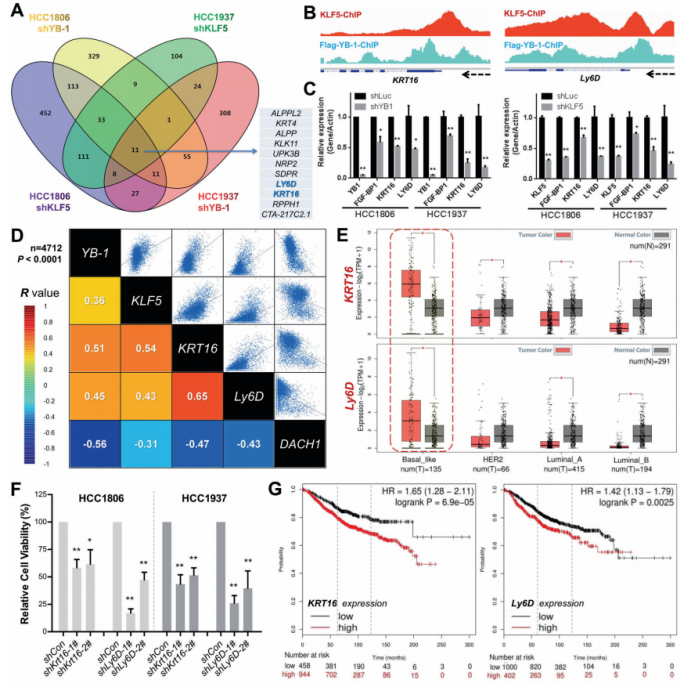
图5. YB-1与KLF5在一个转录复合体互作并共调控一组涉及乳腺癌细胞生长的基因。 6. 角蛋白16 (KRT16)和淋巴细胞抗原家族成员(Ly6D)是由YB-1和KLF5诱导的BLBC特异癌基因 为了进一步探索YB-1与KLF5共调控BLBC细胞增殖机制的下游基因,作者对YB-1和KLF5表达沉默的HCC1806和HCC1937细胞进行RNA测序。差异表达基因中分别有11个和5个基因始终减少或增加(图6.A)。联合ChIP-seq数据分析,在KRT16和Ly6D启动子上鉴定得到Flag-YB-1和KLF5共结合线索(图6.B)。RT-PCR实验进一步证实KRT16和Ly6D由YB-1和KLF5正调控(图6.C)。综合4712个乳腺癌病人的mRNA数据的相关分析揭示YB-1、KLF5、KRT16和Ly6D的表达呈显著正相关(图6.D)。 基于TGCA数据库,作者发现在BLBC亚型中KRT16和Ly6D的mRNA表达特异地增加(图6.E)。敲除KRT16和Ly6D抑制BLBC细胞生长(图6.F),这一证据支持这两个基因在BLBC中的致癌作用。在临床上,KRT16和Ly6D二者任一高表达都预测为差的生存率、无复发生存率以及无转移生存率(图6.G)。总之,上述这些结果暗示KRT16和Ly6D是BLBC新的候选生物标志物和治疗靶点。
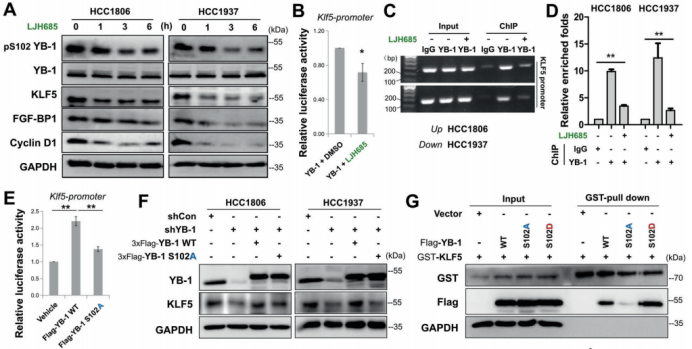
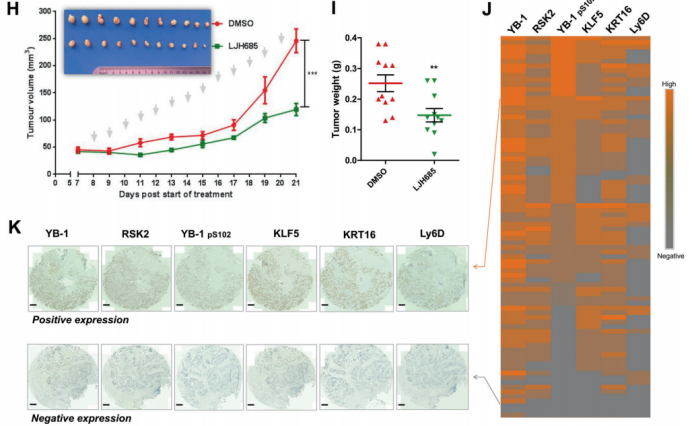
图6. KRT16和Ly6D是由YB-1和KLF5控制的BLBC特异致癌基因 7. RSK(核糖体S6蛋白激酶)的抑制会破坏YB-1和KLF5的复合物,并且抑制BLBC的生长 以往研究显示磷酸化的YB-1(pS102)是乳腺癌患者侵袭性的一个精确指标。作者利用个体药物抑制剂筛选YB-1 pS102的上游激酶。他们发现抑制RSKs,决定了BLBC细胞和一个源自BLBC病人细胞系中YB-1 pS102-KLF5轴的表达(图7.A)。作者进一步研究了为什么pS102对YB-1介导的KLF5表达必不可少。作者利用LJH685抑制YB-1 pS102,发现YB-1介导的KLF5启动子转录激活和其与KLF5启动子结合都被抑制(图7.B-D)。此外,不像YB-1的野生型,YB-1 S102A突变体不能激活KLF5启动子或挽救KLF5的表达(图7.E和F)。随后,作者怀疑YB-1在S102处的磷酸化是否增加了与KLF5的互作。GST-pull down实验显示YB-1 S102A突变体废除了其与KLF5的互作(图7.G)。这些结果暗示YB-1在S102处的磷酸化对YB-1/KLF5转录复合体的形成与下游靶基因的转录至关重要。 然后,作者为了确认RSK抑制剂LJH685能否作为BLBC的潜在治疗药物,在一个HCC1806原位异种移植小鼠模型中评估了LJH685的抗肿瘤效果。尽管该化合物在水中溶解度低、在血液中的半衰期短,服用LJH685后作者观察到明显的肿瘤生长抑制(图7.H和I)。另外,治疗的小鼠体重没有明显下降,意味着它的毒性是可以接受的。作者证明LJH685减少YB-1 pS102、KLF5、KRT16、Ly6D和Cyclin D1的表达,但在异种移植的肿瘤组织中增加了 cleaved-PARP1。综上,LJH685在体内高效地抑制HCC1806细胞的生长,因此它成为治疗BLBC的一种潜在药物。
图7. RSK抑制阻断RSK2-YB-1-KLF5轴,进而抑制BLBC进展 结语该研究证明了KLF5在BLBC细胞的转录和转录后水平上都是YB-1的一个新靶点。此外,YB-1和KLF5作为共转录因子调控一组致癌基因(包括KRT16和Ly6D),促进BLBC细胞增殖。在药物RSK2的抑制后,YB-1-KLF5网络的表达显著降低。作者的数据表明RSK2-YB-1-KLF5-KRT16/Ly6D是一个新型致癌轴调控BLBC细胞生长,突出了这个新的诊断候选标记物和治疗靶点。 原文链接: https://www.nature.com/articles/s41418-021-00920-x |