NEWS
新闻资讯
|
ChIP-seq项目文章 | Nature Plants发表植物抗真菌的免疫新机制
发表单位:中山大学生命科学学院 发表期刊:Nature Plants(17.352) 发表时间:2022年7月18日 研究材料:拟南芥叶片组织 2022年7月18日,中山大学生命科学学院李剑锋教授团队在Nature Plants(IF:17.352)发表题为“Plasma membrane-nucleo-cytoplasmic coordination of a receptor-like cytoplasmic kinase promotes EDS1-dependent plant immunity”的研究论文。 该研究发现拟南芥细胞膜定位的类受体胞质激酶RLCK PBL19在几丁质诱导后通过其N端核定位序列(NLS)从胞膜转移到细胞核。该研究揭示了一个植物此前未知的几丁质信号分支,通过该信号几丁质诱导的PBL19 质膜-核易位协调其转录自调控和胞质的PBL19介导的EDS1磷酸化促进抗真菌免疫。爱基百客为其提供ChIP-seq的技术支持。
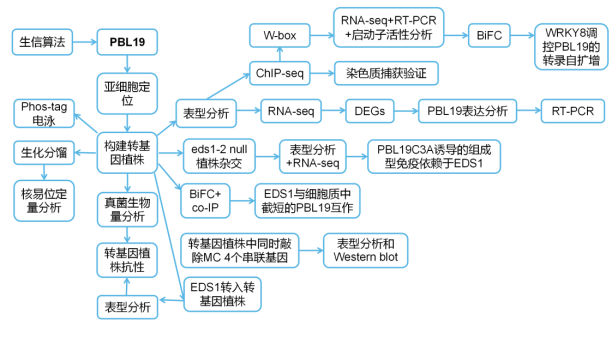
研究背景 为了确保强大的免疫反应,植物进化出了一个复杂的监测网络,由质膜(PM)和细胞内免疫受体组成,它们结合起来确定入侵病原体的身份。植物利用细胞表面免疫受体识别病原特异性模式,以唤起基础免疫。加强疾病易感性(EDS1)在植物基础免疫中起着至关重要的作用,但其模式识别的激活机制仍是一个谜。 研究思路
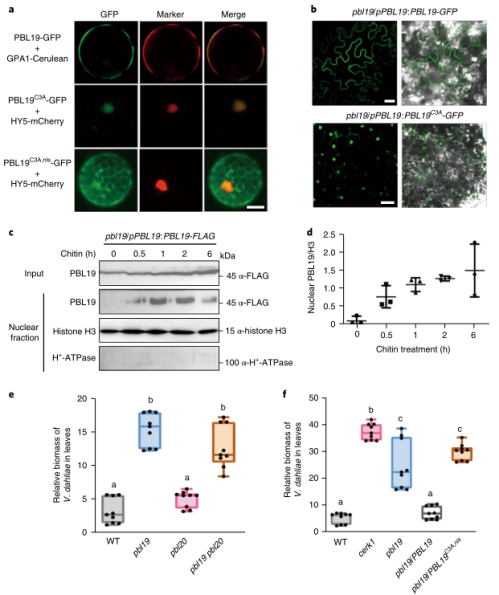
研究结果 01 PBL19在N端有一个功能性的核定位序列 新证据表明细胞膜相关的激酶可以通过调控植物的核运输来介导免疫信号。在拟南芥中,大多数RLCK VII亚家族成员通过蛋白棕榈酰化可逆地连接到PM的胞质侧。作者利用算法发现了一个推测的双边核定位序列(NLS),命名为KKPRKQQKDNNKNKRKG,它来自PBL19的N端。 为了验证PBL19的亚细胞定位,作者在原生质体中瞬时表达PBL19或棕榈酰缺失的PBL19C3A变体。结果发现PBL19与棕榈酰GPA1共定位于细胞膜上,而PBL19C3A变体与转录因子HY5在细胞核上重叠(图1a)。构建转基因互补植株,结果与原生质体数据相同,PBL19和PBL19C3A在相应转基因植物中分别主要位于细胞外围和细胞核内(图1b)。 为了验证PBL19中预测的NLS的功能,作者测试其是否能驱动mCherry-GUS进入细胞核。mCherry-GUS是一个胞质蛋白,会由于核孔大小排斥。原生质体实验结果表明核定位序列是功能性的,是PBL19潜在核通路所必需的。
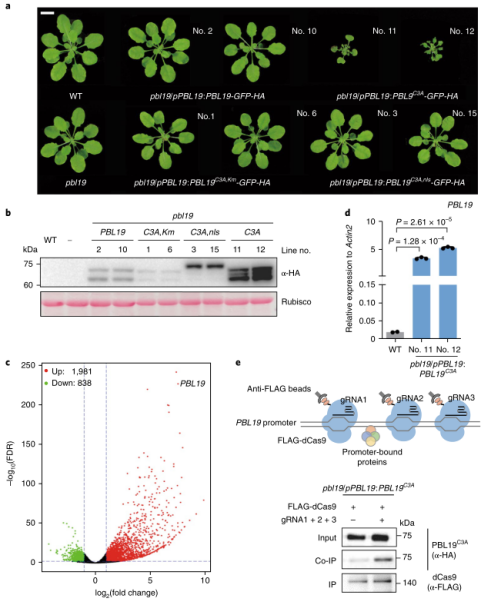
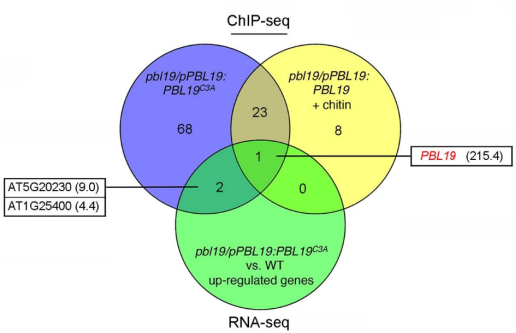
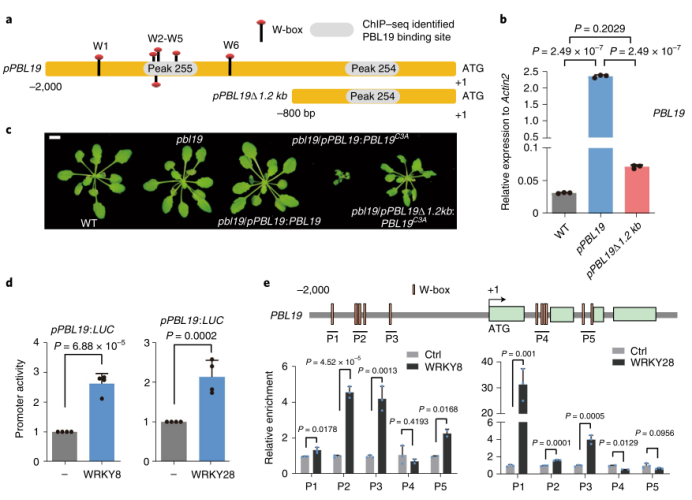
图1 几丁质诱导的PBL核易位 02 几丁质诱导PBL19质膜-核易位 此前研究表明PBL19在几丁质信号通路中被证明是CERK1的下游元件。因此,作者测试几丁质是否影响PBL19的亚细胞定位,并发现暴露在几丁质1小时后一部分瞬时表达的PBL19-GFP蛋白从质膜转移到细胞核。 为了巩固这一发现,作者使用转基因互补植株进行生化分馏实验。几丁质诱导后30分钟可以在富核部分检测到PBL19蛋白,诱导2小时后PBL19的核积累趋于稳定(图1c,d)。这些结果暗示几丁质特异地诱导部分PBL19蛋白进入细胞核。 本研究和其他研究发现PBL19和PBL20以冗余的方式介导几丁质诱导的MAPK激活。如果几丁质诱导的PBL19而不是PBL20的核易位具有重要的生物学意义,作者认为在拟南芥中PBL19和PBL20对真菌抗性的贡献是不相等的。实际上,根据PCR方法对地上组织真菌生物量进行定量分析,pbl19 null植株比pbl20 null植株和野生型植株对大丽黄萎病菌(一种破坏性的土壤真菌病原体)更敏感(图1e)。 大丽黄萎病菌抗性在pbl19/pPBL19:PBL19-GFP-HA植株中完全恢复,而在pbl19/pPBL19:PBL19C3A,nls-GFP-HA植株未恢复。这些结果表明,几丁质诱导的PBL19核易位与植物抗真菌免疫具有生物学相关性。 03 PBL19C3A诱导组成型免疫 为了了解细胞核定位的PBL19功能,作者研究了pbl19/pPBL19:PBL19C3A-GFP-HA转基因植株,其模拟PBL19在持续几丁质暴露下的持续核易位。多个转基因株系表现出严重的生长迟缓(图2a),这让人联想起常见的由PTI共受体激酶(如BAK1和SOBIRI)超表达引起的组成型免疫。相反,pbl19/pPBL19:PBL19-GFP-HA、pbl19/pPBL19:PBL19C3A,Km-GFP-HA 和pbl19/pPBL19:PBL19C3A,nls-GFP-HA转基因植株表现出正常的生长状态,这暗示激酶活性和核定位的PBL19都是组成型免疫不可或缺的。 为了获得PBL19C3A如何诱导组成型免疫的线索,作者对pbl19/pPBL19:PBL19C3A-GFP-HA转基因植株进行RNA-seq分析,并鉴定到2819个差异表达基因(图2c)。值得注意的是PBL19表现出214倍的转录上调,而其他RLCK VII基因最多上调5倍。PBL以及几个防御标记基因的转录变化通过RT-PCR验证(图2d)。 为了区分核定位PBL19直接上调的基因和次级转录调控基因,作者利用相应的转基因植物(PBL19C3A变体或1h几丁质诱导PBL19处理的植株)进行ChIP-seq分析。PBL19基因组片段与PBL19C3A和几丁质诱导PBL19都共沉淀。作者采用CRISPR衍生的染色质捕获实验证实PBL19C3A与PBL19启动子之间共沉淀(图2e)。总之,这些结果表明核定位的PBL19停留在DNA结合的蛋白复合物中,促进其自身的转录。
图2 PBL19C3A诱导组成性免疫和转录自扩增
RNA-seq和ChIP-seq共分析显示PBL19(红色)由PBL19C3A上调,同时与核定位的PBL19结合 04 WRKY8调控PBL19转录自扩增 由ChIP-seq鉴定的PBL19启动子片段(peak 255)覆盖了4个预测的W-box(图3a)。与2Kb的PBL19启动子相比,缺少所有W-box的截短的PBL19启动子的PBL19C3A表达量显著降低(图3b),其导致组成型免疫(图3c)。这些发现暗示PBL19可能通过WRKY-W-box互相作用调节自身的转录。 根据RNA-seq和RT-qPCR分析,WRKY IIc支4个密切相关的基因(WRKY8、 WRKY28、WRKY48和WRKY71),在 pbl19/pPBL19:PBL19C3A-GFP-HA转基因植株中被诱导到不同的水平。在protoplast-based promoter-LUC实验中,WRKY8或WRKY28而不是WRKY48和WRKY71的表达增加PBL启动子的活性(图3d)。相反,WRKY8和WRKY28无法增强突变的PBL19启动子(W-boxes破坏)的活性。此外,WRKY8和WRKY28都可以结合到PBL19启动子的远端区域,该区域含有聚集的W-boxes(图3e)。 通过双分子荧光互补(BiFC)实验,观察PBL19在几丁质诱导下与细胞核内的WRKY8和WRKY28相互作用(图3f),而PBL19C3A与WRKY8和WRKY28在细胞核内持续互相作用。 利用CRISPR/Cas9技术靶向WRKY8和WRKY28,pbl19/pPBL19:PBL19C3A-GFP-HA转基因植株让它们两个基因都缺失会相当地减弱PBL19C3A的表达以及组成型免疫(图3g,h),而在野生型植株中敲除这些基因中和其对大丽黄萎病菌的抗性。敲除WRKY8足以抑制PBL19C3A表达和组成型免疫,程度类似于两个WRKYs的丧失,这证实WRKY8参与到PBL19的转录自扩增。由于WRKY28能与WRKY8在BiFC实验中互作,作者认为不能排除WRKYs异源二聚体协同调控PBL19转录的可能性。
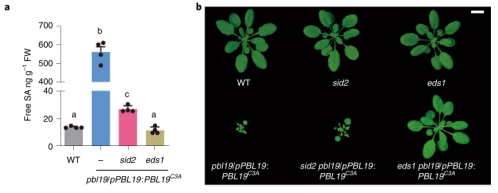
图3 WRKY8参与PBL19的转录自扩增。 05 PBL19C3A诱导的组成型免疫依赖于EDS1 SA(水杨酸)诱导的标记基因PR1(致病相关基因)在pbl19/pPBL19:PBL19C3A-GFP-HA转基因植株中被高度诱导,作者证明在这些植物中SA确实过度积累(图4a)。因此,作者将pbl19/pPBL19:PBL19C3A-GFP-HA转基因植株与SA生物合成缺陷的sid2-3植株进行杂交。尽管在sid2 pbl19/pPBL19:PBL19C3A-GFP-HA植株中,SA过度积累被显著抑制(图4a),植株的侏儒症只得到轻微缓解(图4b),以及很多与防御相关的基因被上调(图4c),这表明PBL19C3A介导的组成型免疫很大程度上独立于水杨酸。 当SA生物合成被禁用时,植物免疫核心调节因子EDS1能保留SA响应基因的诱导,故作者将pbl19/pPBL19:PBL19C3A-GFP-HA植株与eds1-2 null植株杂交。得到的eds1 pbl19/pPBL19:PBL19C3A-GFP-HA植株完全恢复到野生型外观(图4b)。此外,SA的过度积累和上调的防御相关基因大部分被EDS敲除所抑制(图4a,c)。这些结果表明PBL19C3A诱导的组成型免疫依赖于EDS1。
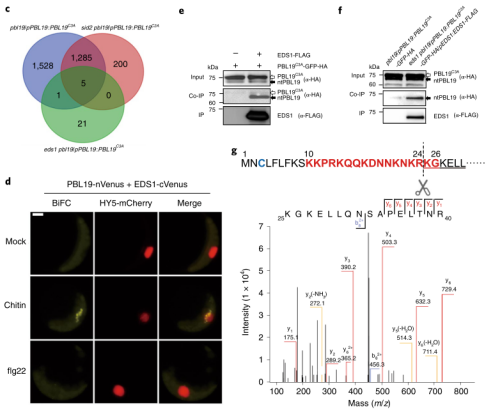
图4 EDS在PBL19介导的免疫中起着关键作用 06 EDS1与细胞质中截短的PBL19互相作用 BiFC实验显示EDS1可能与PBL19核外的点状结构互作,而且这种互作仅发生在几丁质处理后,而不是flg22处理后(图4d)。EDS1持续与PBL19C3A以类似的模式在胞质内互作。作者随后利用co-IP实验证明了这种互作模式(图4f)。 为了验证ntPBL19的同源性,作者通过IP从pbl19/pPBL19:PBL19C3A-GFP-HA植株中富集ntPBL蛋白,并通过质谱分析ntPBL19的序列。质谱捕获到ntPBL19最多的N端肽是“KGKELLQNSAPELTNR”(图4g),暗示ntPBL丢失N端棕榈酰化位点以及NLS(图4g)。 作者构建了pbl19/pPBL19:PBL19Δ1-24-GFP-HA转基因互补植株,作者发现多个株系表达的PBL19Δ1-24 蛋白表现出与由pbl19/pPBL19:PBL19C3A-GFP-HA植株产生的ntPBL19蛋白几乎一样的分子大小。然而,PBL19Δ1-24的丰度明显低于PBL19C3A,这可能是由于缺乏PBL19介导的细胞核自转录扩增。这些结果表明低丰度的ntPBL19不足以诱导强的组成型免疫。
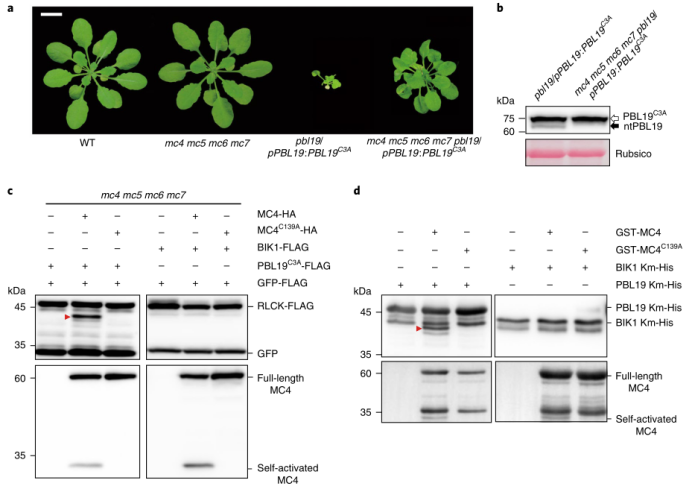
图4 EDS1在PBL19介导的免疫中起着关键作用 07 MC4可能切割PBL19产生ntPBL19 ntPBL19上游的残基是精氨酸(Arg24)。最近的发现flg22可以诱导拟南芥II型半胱氨酸蛋白酶切割底物蛋白,促使作者测试是否这些蛋白是否参与ntPBL19的产生。作者发现在pbl19/pPBL19:PBL19C3A-GFP-HA背景中CRISPR/Cas9同时敲除METACASPASE 4(MC4)-MC7,四个串联连接的异源基因,显著抑制了组成型免疫并减少了ntPBL19的产生(图5a,b)。体内和体外蛋白表达实验证明ntPBL19极有可能是MC4裂解产生的,而MC4裂解又有助于PBL19介导的免疫。
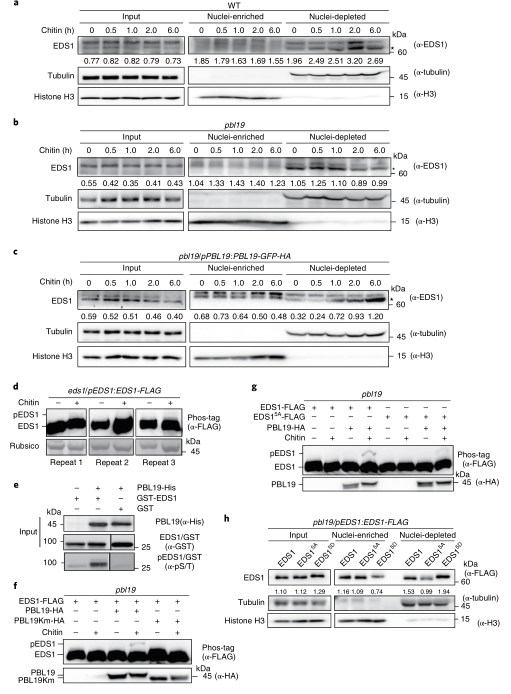
图5 Metacaspase MC4可能介导ntPBL19的产生。 08 几丁质通过PBL19诱导EDS1在细胞质积累 EDS1的核积累对其在效应器触发免疫中的功能非常有必要,这促使作者使用此前报道的抗EDS1抗体来评估内源性EDS1在几丁质触发的PTI的亚细胞分布。作者发现几丁质处理可诱导EDS1在野生型和pbl19/pPBL19:PBL19-GFP-HA植株中积累,但在pbl19基因缺失植株中不存在(图6a-c)。相反,flg22诱导对EDS1的核质分布几乎没有影响。这些发现暗示几丁质可以通过PBL19依赖的方式诱导EDS1的细胞质富集。 几丁质诱导后1h,在eds1/pEDS1:EDS1-FLAG转基因互补植株中通过Phos-tag电泳检测到磷酸化的EDS1(图6d)。纯化重组PBL19可以在体外磷酸化细菌表达的EDS1(图6e)。质谱分析让作者确定了EDS1中Ser216、Thr230、Ser319、Thr482和Thr623位点为PBL19介导的磷酸化位点。当这些残基突变为丙氨酸时,PBL19仍然可以在体外磷酸化EDS15A,尽管水平低很多。此外,将EDS15A取代为EDS1,PBL19介导的EDS1在几丁质诱导下的磷酸化水平显著降低。 为了弄清几丁质诱导的EDS1的细胞质积累是否与其磷酸化状态有关,作者比较仿磷酸化EDS15D和磷缺乏的EDS15A变体的亚细胞分布,这两个变体是在pbl19 缺失的转基因植株用其自身的启动子驱动表达。EDS15D似乎比EDS15A在细胞质中积累更多(图6h)。原生质体中的结果与此类似。这些结果表明PBL19介导的EDS1磷酸化可能促进其在几丁质诱导下的细胞质积累。
图6 EDS1的细胞质积累是由几丁质诱导或磷样突变诱导 09
当EDS1在其本地启动子的控制下被引入到eds1 pbl19/ pPBL19:PBL19C3A-GFP-HA植株中,可以恢复严重的植物发育不良(图7a),从而验证了PBL19C3A介导的组成型免疫依赖于EDS1。相反,EDS15A在eds1 pbl19/pPBL19:PBL19C3A-GFP-HA植株中的互补表达仅导致中等侏儒(图7a),暗示EDS15A在PBL19介导的免疫中部分丧失功能。 为了评估EDS1磷酸化可能的生理作用,作者比较了转基因植株之间的抗性差异,结果提示EDS15D能够弥补PBL19在宿主中抗真菌免疫的缺失。EDS15A和EDS15D的突变分别会导致植株抗性(抗黄萎病菌)部分减弱或增强。这些结果表明EDS1正调控植物抗真菌免疫,其磷酸化可能在这一过程中起重要作用。
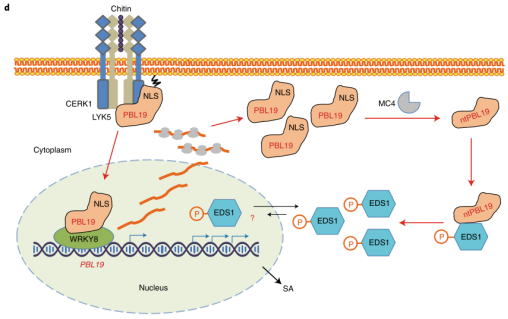
图7 拟南芥PBL19介导的免疫工作模型。 研究结论
在该研究中,作者报道了拟南芥RLCK PBL19通过N端核定位序列经几丁质诱导后可从胞膜转移到细胞核。PBL19C3A是一种持续核定位的PBL19变体,主要通过WRKY8在转录自扩增的前提下诱导EDS1依赖的组成型免疫。EDS1特异地与细胞质中metacaspase处理的缺乏NLS的PBL19互相作用。PBL19具有磷酸化EDS1的能力,磷拟态EDS1对PBL19缺失的植株的真菌敏感性有抑制作用,其中几丁质诱导的PBL19的质膜-细胞核易位与其转录自调节和细胞质中PBL19介导的EDS1磷酸相协调,从而促进抗真菌免疫。 文献链接:DOI: 10.1038/s41477-022-01195-x 百度网盘链接: --往期推荐-- ChIP-seq介绍 将染色质免疫共沉淀与第二代测序技术相结合的ChIP-Seq技术,能够高效地在全基因组范围内检测与组蛋白、转录因子等互作的DNA区段。首先通过染色质免疫共沉淀技术(ChIP)特异性地富集目的蛋白结合的DNA片段,并对其进行纯化与文库构建;然后对富集得到的DNA片段进行高通量测序。研究人员通过将获得的数百万条序列标签精确定位到基因组上,从而获得全基因组范围内与组蛋白、转录因子等互作的DNA区段信息。 技术路线
ChIP-seq作为爱基百客的王牌产品,拥有丰富的项目经验,有相关需求的老师可以和我们联系。目前正在进行的ChIP-seq活动超值哦! |