NEWS
新闻资讯
|
国自然热点 | 一文了解铁死亡及其研究思路铁死亡 (Ferroptosis) 是一种铁依赖性的,区别于细胞凋亡、细胞坏死和细胞自噬的新型的细胞程序性死亡方式。铁死亡的的本质是谷胱甘肽的耗竭,谷胱甘肽过氧化物酶(GPX4)活性下降,脂质氧化物不能通过GPX4催化的谷胱甘肽还原酶反应代谢,之后二价的铁离子氧化脂质产生活性氧,从而促使铁死亡的发生。 一、铁死亡的十年之旅 这一词汇最早由哥伦比亚大学Dr. Brent R.Stockwell在2012年提出,十年后Brent R.Stockwell在Cell (IF=66.85)上发表了题为《Ferroptosis turns 10:Emerging mechanisms, physiological functions, and therapeutic applications(铁死亡的十年:新兴机制、生理功能,及其治疗应用)》的文章,深度阐述了铁死亡的机制、生物学意义和临床治疗相关性,以及主要未解决的问题。
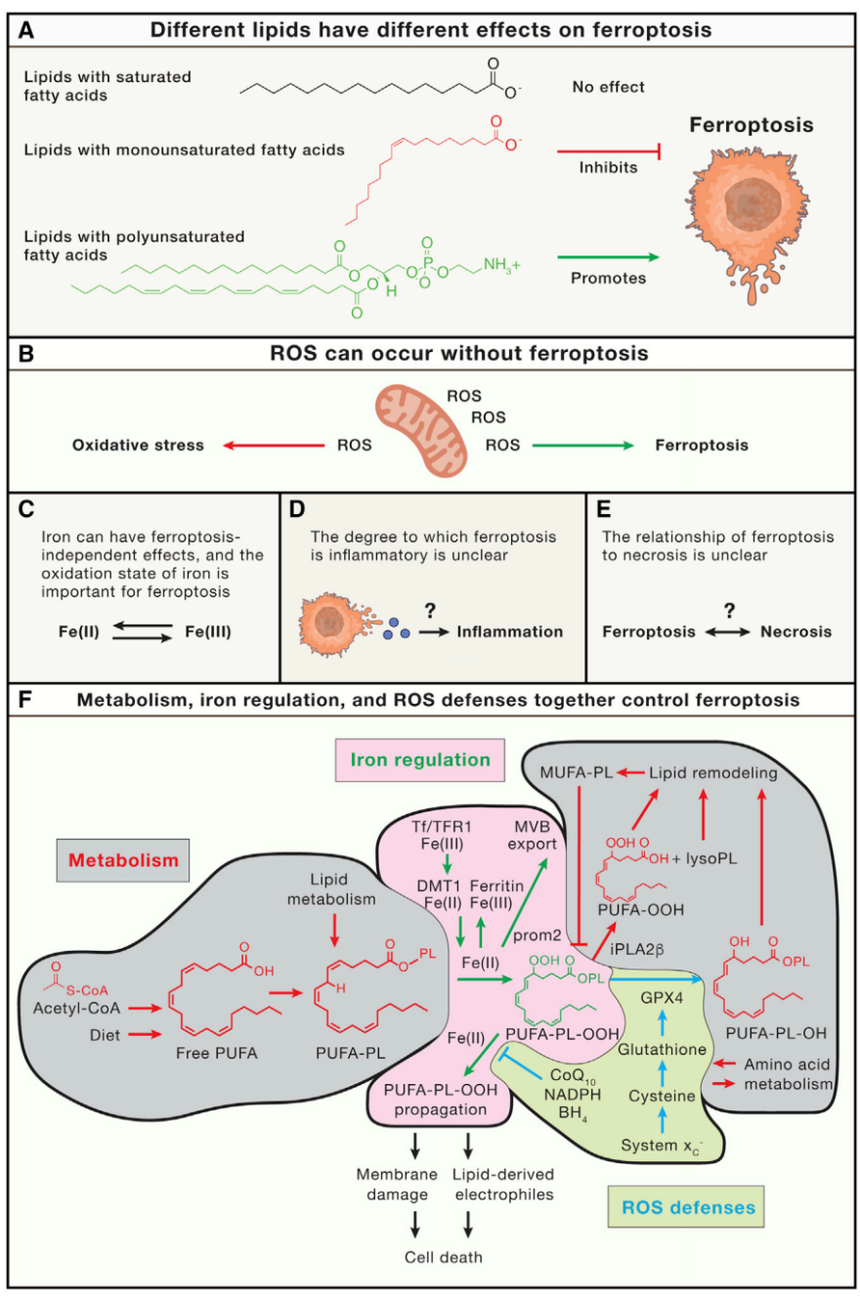
最近几年,人们对铁氧化机制的认识取得了重大进展,影响了大家对铁氧化在生物学和医学中的作用的认识。众多研究人员阐明了铁氧化过程中发生氧化并驱动细胞死亡过程的特定脂质、抑制铁氧化的内源机制、控制铁氧化敏感性的铁调节关键环节以及有助于铁氧化的细胞器[1]。Stockwell实验室在新陈代谢、活性氧生物学和铁调节的交叉处为中心的框架内总结了铁死亡的范式,同时也总结了六个有助于理解铁死亡反应的关键概念[2]。 铁死亡与ROS的产生并不能划等号,有可能产生ROS但没有发生铁死亡。并且铁死亡通常涉及特定脂质的氧化,而不是ROS的普遍积累。 被氧化的脂质具有不同促进铁死亡的能力,而另一些脂质,如MUFA,则能够抑制铁死亡。目前对在各种情况下促进铁凋亡的特异性脂质的研究还在进行中。 铁除了诱导铁死亡外有许多作用,铁的积累并不等于铁死亡。此外,铁的氧化态对于其促进铁凋亡的能力是重要的:Fe(II)促进铁死亡,而Fe(III)通常是惰性的并且储存在铁蛋白中,除了在脂氧合酶的活性位点中,也是酶的活性形式。因此,确定铁的氧化还原状态以及它在特定情况下是否对铁死亡反应有特殊作用非常重要。 铁死亡与细胞凋亡、细胞焦亡、程序性坏死和不受调节的坏死明显不同。至于是否可将铁死亡归类为坏死的一种类型,需要对其相关功能的进一步明确。 在不同情况下,铁死亡与炎症和/或免疫原性的关联程度仍不确定。一些研究表明,铁死亡有助于炎症或免疫原性,但程度如何,以及铁死亡反应与细胞焦亡、坏死性凋亡或细胞凋亡在免疫相关作用方面的比较仍不确定。 新陈代谢、铁代谢调控和ROS防御系统共同控制着细胞对铁死亡的敏感度。因此,扰乱新陈代谢、铁离子平衡和ROS水平是调节细胞对铁变态反应易感性的关键手段。
总的来说,新陈代谢、铁调控和ROS生物学这三个领域的探究与发展,共同促进了铁死亡领域的迅速发展。新陈代谢解释了铁死亡的关键底物是如何产生和重塑的;铁的调控揭示了如何控制Fe(II)的可用性;而ROS生物学揭示了针对脂质过氧化的内源性防御如何发挥作用。
铁死亡年度中标量统计(数据来源:ZCOOL) 铁死亡作为连续多年的国自然研究热点方向,学者们对其研究热情居高不下,相关项目年中标量也是稳步上升,但仍有许多需要解决的问题。热死亡概念提出者Stockwell总结了三个关键未解之谜,对解决铁死亡研究瓶颈至关重要。 铁死亡反应是由特定细胞器中特定含有PUFA的脂质过氧化作用驱动的。至于如何、在何处以及何时导致细胞死亡,目前尚不清楚。 目前Glu、铁的过载、SLC7A11的抑制、GPX4的耗竭和PUFA的摄取被广泛认可是铁死亡的触发因素。定义铁死亡的启动机制和其发生的环境将大大丰富我们从生物学和医学角度对铁死亡的理解。 这种在特定组织、细胞和/或疾病环境中的选择性激活或抑制对将铁死亡的基础知识转化为治疗方法至关重要。举个例子,系统地靶向GPX4可能引起毒性,例如肾损伤、神经变性或其他器官损伤。那么选择性靶向顽固肿瘤细胞可能会产生影响,这可能提供一个治疗安全窗口 二、铁死亡机制研究的案例 索拉非尼是一种酪氨酸激酶抑制剂,作为铁死亡诱导剂在包括胃癌(GC)在内的多种癌症中具有重要的抗肿瘤作用。然而,索拉非尼作为铁死亡诱导剂的地位最近受到质疑。激活转录因子2(ATF2)是ATF/CREB转录因子(TFs)家族的成员,它与细胞增殖、细胞凋亡和DNA修复等一系列与癌症相关的生物功能有关。但是关于铁死亡与 ATF2之间关系的信息非常有限,ATF2 在索拉非尼诱导的铁死亡中的作用尚未得到研究。 今年2月份发表在《Redox Biology》(IF=10.787)杂志上的一篇文章确认了索拉菲尼诱导胃癌细胞铁死亡。该文章研究了ATF2在索拉非尼诱导的GC铁死亡中的作用及其分子机制。结果发现ATF2在GC组织中显著上调,预示着临床预后较差[3]。沉默ATF2显著抑制了GC细胞的恶性表型。此外,还观察到ATF2在索拉非尼诱导的GC细胞铁死亡过程中被激活。ATF2敲低促进了索拉非尼诱导的GC细胞的铁死亡,而ATF2过表达在GC细胞中则显示相反的结果。
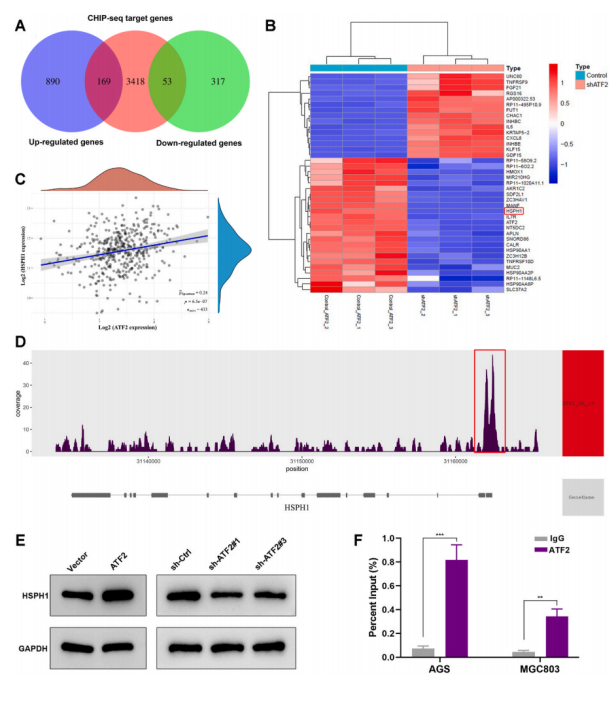
研究方法上,使用ChIP-Seq和RNA-Seq,将HSPH1鉴定为ATF2的靶标,并通过ChIP-qPCR分析进一步验证。HSPH1可以与SLC7A11(胱氨酸/谷氨酸转运蛋白)相互作用并增加其蛋白质稳定性。重要的是,HSPH1的敲低部分逆转了ATF2过表达对索拉非尼诱导的GC细胞铁死亡的影响。此外,肿瘤异种移植模型的结果表明,ATF2敲低可以有效增强体内索拉非尼的敏感性。总的来说,该研究揭示了索拉非尼在GC中诱导铁死亡的新机制。
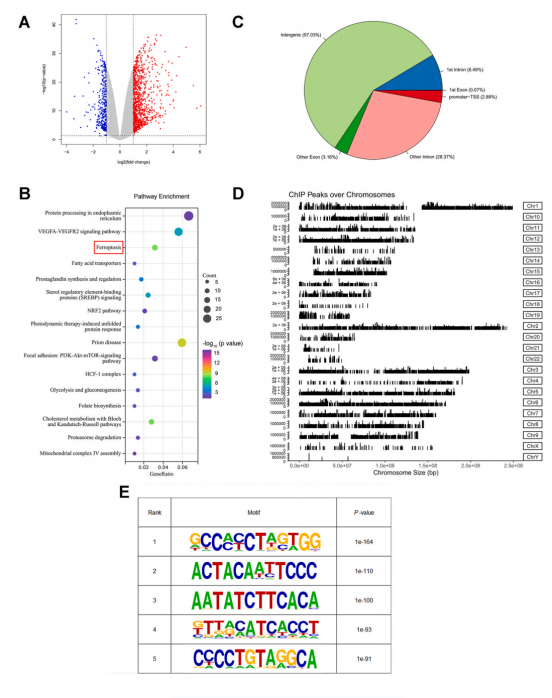
解决问题:ATF2下调加强索拉非尼诱导的GC细胞铁死亡的机制如何实现? 作者使用RNA-seq和ChIP-seq技术鉴定了ATF2的全基因组DNA结合位点和潜在的转录靶点。通过RNA-seq发现MGC803细胞中ATF2敲低后,有1059个基因上调,370个基因下调,并且富集分析表明,ATF2敲低显著影响铁死亡途径;通过ChIP-seq共鉴定出3641个RefSeq基因对应的24119个峰,其中2.88%位于启动子转录起始位点,在染色体上观察到不同的峰值,并预测与ATF2结合motif。 对RNA-seq和ChIP-seq数据进行了合并分析,筛选出了222个受ATF2直接调控的候选转录靶标。其中HSPH1在ATF2敲除后明显下调,在TCGA(The cancer genome atlas,癌症基因组图谱)中,HSPH1在GC中的表达与ATF2呈显著正相关。ChIP-seq数据在HSPH1启动子区域发现了明显的ATF2结合峰。由此推测 HSPH1可能是ATF2的潜在靶基因。 通过WB实验和ChIP-qPCR进一步证实,ATF2可以结合到HSPH1的启动子区域。
除了铁死亡之外,m6A在国自然热点中近几年保持较高水平。m6A甲基化修饰是哺乳动物体内最普遍的一种mRNA修饰,在癌症发病机理中具有非常关键的作用。RNA的m6A甲基化一共有大三类酶参与:甲基化转移酶(Writers)、去甲基化酶(Erasers)和甲基化阅读蛋白(Readers)等共同参与,且是可逆化的。RNA的m6A甲基化主要分布在mRNA中,也出现在非编码RNA如tRNA、rRNA和lncRNA。 在先前的研究中,学者们认为铁死亡与肿瘤进展和抗肿瘤治疗的耐药性有关。lncRNA在肿瘤细胞的各种生物学过程中发挥着调控作用,而在胶质瘤中,lncRNA在铁凋亡中的功能和分子机制尚待明确。在今年5月份发表在《Journal of Experimental &Clinical Cancer Research》(IF=12.658)杂志上的一篇文章结合了lncRNA、m6A和铁死亡三大国自然热点,解析了SNAI3-AS1/SND1/Nrf2在胶质瘤铁死亡中的作用及机制[4]。
作者发现铁死亡诱导剂erastin通过增加启动子内CpG岛的DNA甲基化水平抑制SNAI3-AS1的表达,SNAI3-AS1是胶质瘤的肿瘤抑制因子。重要的是,SNAI3-AS1在体外通过促进铁死亡来增强erastin的抗肿瘤活性。机制上,SNAI3-AS1与SND1竞争性结合,干扰了SND1对Nrf2 mRNA 3'UTR的m6A依赖性识别,从而降低了Nrf2 mRNA稳定性。拯救实验证实,SND1的过表达和沉默可分别拯救SNAI3-AS1的功能增加和功能缺失铁死亡表型。 研究方法上,通过功能获得和功能丧失实验,在体外和体内研究SNAI3-AS1对胶质瘤发生和铁死亡易感性的影响。通过生物信息学分析、BSP(亚硫酸盐测序PCR)、RNA pull-down、RIP、MeRIP、双荧光素酶报告基因检测等方法,探讨SNAI3-AS1在胶质瘤中低表达的机制及SNAI3-AS1在铁死亡易感性中的下游机制。
解决问题:验证SNAI3-AS1是否通过海绵miRNA调节Nrf2 mRNA的稳定性 作者进行了RIP实验,发现与IgG对照组相比,Ago2抗体组没有检测到SNAI3-AS1的富集。通过RNA pull down实验和RIP/RT-qPCR分析进一步证实SNAI3-AS1和SND1之间的物理相互作用,这与FISH/IF共定位实验显示SNAI3-AS1和SND1在细胞质中共定位的结果一致。
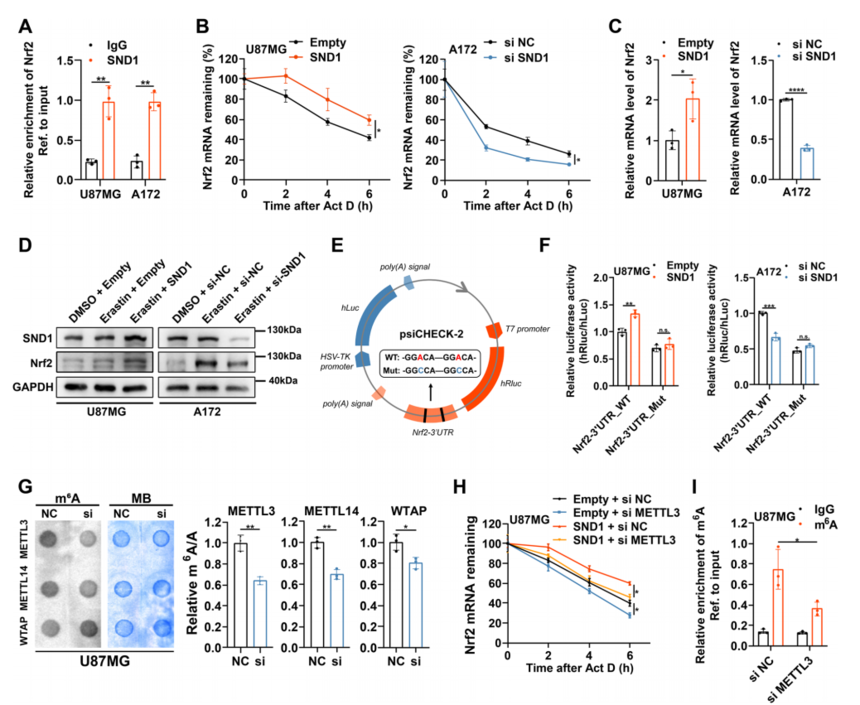
解决问题:验证SND1参与Nrf2 mRNA稳定性的调控 作者进行RIP/RT-qPCR分析,结果显示与抗IgG组相比,抗SND1组Nrf2 mRNA明显富集(图A)。放线菌素D检测显示,过表达SND1可导致Nrf2 mRNA稳定性显著升高,而沉默SND1则会产生相反的效果(图B)。还观察到SND1过表达或沉默后Nrf2 mRNA和蛋白水平的一致变化(图C, D)。 为了确认SND1是否以m6A依赖的方式调控Nrf2 mRNA,构建了双荧光素酶报告质粒,在Nrf2 3'UTR序列中含有野生型(Nrf2-3'URT_WT)或突变型(Nrf2-3'URT_MT) m6A位点(图E)。荧光素酶报告基因检测显示,具有野生型m6A位点的报告基因的相对荧光素酶活性在过表达SND1后增加,而在沉默SND1后下降(图F)。这表明SND1通过识别Nrf2 mRNA 3'UTR序列中的m6A位点调控Nrf2 mRNA。 m6A甲基化水平是由m6A甲基转移酶直接决定的,主要包括MELLT3、METTL14和WTAP。沉默METTL3后,在U87MG细胞中,与沉默METTL14和WTAP相比,观察到m6A甲基化水平的下降更为明显(图G)。此外,公共数据库显示METTL3与Nrf2之间存在显著的正相关关系。放线菌素D检测显示,沉默METTL3可阻断SND1,加速Nrf2 mRNA的稳定性(图H)。应用MeRIP-qPCR进一步证实Nrf2 mRNA的m6A依赖性修饰。结果显示,METTL3沉默后,Nrf2 mRNA的m6A甲基化水平在m6A位点周围明显降低(图I)。 以上结果表明SND1以依赖m6A的方式促进Nrf2 mRNA的稳定性。
三、总 结 铁死亡的研究思路基本遵循:表型→蛋白表达→分子表达→基因敲除/过表达逆转表型,通过对形态特征、基因表达、蛋白水平以及生化特征的监测研究铁死亡的功能与机制。表观遗传修饰在细胞铁死亡中的可能调控作用:对于蛋白互作探究可以使用酵母双杂交技术、免疫共沉淀、GST pull-down实验、IP-MS技术;涉及到蛋白质与DNA互作研究可使用ChIP-seq、CUT&Tag,涉及到蛋白质与RNA互作研究(如m6A)RIP-seq、CLIP-seq等。 四、话题延申 与铁相似,铜也是所有生物体内不可缺少的一种微量元素,通常在哺乳动物细胞内维持极低的水平。细胞内的铜离子浓度超过了维持稳态机制的阈值时,同样会表现出细胞毒性。2022年3月,美国Broad研究所的Peter Tsvetkov和Todd R. Golub团队在science上合作发表题为《Copper induced cell death by targeting lipoylated TCA cycle protein》的研究论文,将其正式命名为“铜死亡”(Cuproptosis)。现有研究表明许多疾病的发生过程都离不开铜死亡的参与,所以对于铜死亡调控机制的研究十分火热。后续我们将带来有关铜死亡更深入的介绍,敬请期待......
[1]Jiang X,Stockwell BR,Conrad M. Ferroptosis: mechanisms, biology and role in disease. Nat Rev Mol Cell Biol. 2021;22 (4):266-282. doi:10.1038/s41580-020-00324-8 [2]Stockwell BR. Ferroptosis turns 10: Emerging mechanisms, physiological functions, and therapeutic applications. Cell. 2022;185 (14):2401-2421. doi:10.1016/j.cell.2022.06.003 [3]Xu X,Li Y,Wu Y, et al. Increased ATF2 expression predicts poor prognosis and inhibits sorafenib-induced ferroptosis in gastric cancer. Redox Biol. 2023;59:102564. doi:10.1016/j.redox.2022.102564 [4]Zheng J,Zhang Q,Zhao Z, et al. Epigenetically silenced lncRNA SNAI3-AS1 promotes ferroptosis in glioma via perturbing the m 6 A-dependent recognition of Nrf2 mRNA mediated by SND1. J Exp Clin Cancer Res. 2023;42 (1):127. doi:10.1186/s13046-023-02684-3 了 解 更 多 { 往 期 精 彩 回 顾 } 精选合集,欢迎收藏哟! |