NEWS
新闻资讯
|
Nature Commun|CUT&Tag助力研究表观遗传修饰调节小麦不同品种根系发育和低氮适应性提高氮素利用效率(NUE)的作物育种对可持续农业至关重要,但表观遗传修饰的参与仍未得到探索。2023年12月12日,中国科学院遗传与发育生物学研究所肖军研究组与合作者在Nature Communications杂志上发表了题为“Epigenetic modifications regulate cultivar-specific root development and metabolic adaptation to nitrogen availability in wheat”的研究论文,该文章聚焦两个低氮下生长存在差异的代表性小麦品种:科农9204 (KN9204)和京411 (J411),并分别在正常氮(Normal nitrogen, NN)和低氮(Low nitrogen, LN)条件下,利用CUT&Tag技术(爱基百客可提供该技术服务)绘制了这两个品种各三种组织(根、旗叶、种子)的多种组蛋白修饰景观。
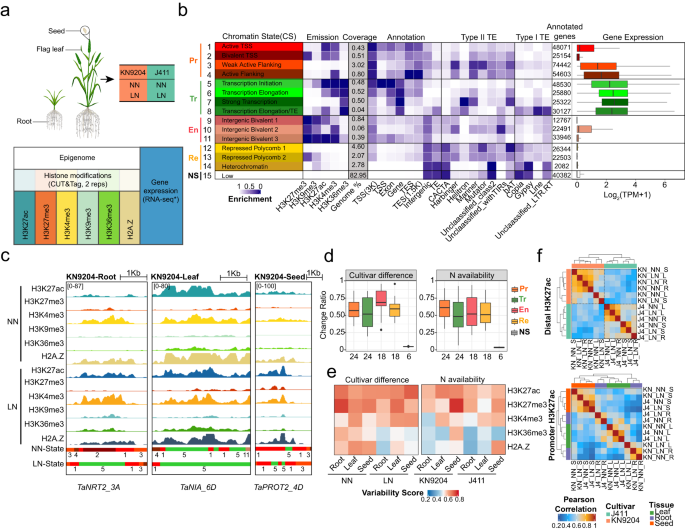
1. 不同氮素条件下组织特异性染色质景观分析 使用CUT&Tag方法对小麦品种KN9204和J411在NN和LN条件下的根(28天)、旗叶(抽穗期)和籽粒(开花后21天)进行了染色质表观遗传修饰的谱系分析(fig.1a),以揭示转录调控的表观遗传调控机制。结果表明,该方法在小麦中的有效性得到了充分验证,与先前发表的ChIP-seq数据相比,具有高度相关性(Cor = 0.91/0.85),并表现出良好的重复性。 利用ChromHMM22对小麦基因组的染色质状态进行了系统定义,共识别出15种染色质状态(CS),包括Promoter、Transcription、Enhancer-like、Repressive和No signal等五大类,各类别具有不同的基因组覆盖度、转座子富集度和基因表达水平(fig.1b)。其中,Promoter和Enhancer-like CS与H3K27ac、H3K4me3和H3K27me3等染色质修饰相关,分别位于转录起始位点(TSS)和genic区域。Repressive CS主要富集于H3K27me3,约占基因组的10%。No signal CS则占据了基因组的大部分(约83%)(fig.1b)。在不同小麦品种、不同组织和不同氮环境条件下,染色质状态的变化对小麦生理和生化过程的表达调控具有重要意义(fig.1c)。其中,Enhancer-like CS是不同品种间最可变的染色质区域,而Promoter CS则主要受氮环境调控影响(fig.1d)。此外,本文还分析了不同染色质修饰的变异性评分,发现H3K27ac和H3K27me3在不同类型氮环境和不同小麦品种间具有最高变异系数(fig.1e)。进一步分析表明,distal H3K27ac表现出品种特异性,而Promoter H3K27ac则更依赖于组织特异性。对于H3K27me3标记,无论是distal还是promoter峰值都表现出品种特异性(fig.1f)。因此,小麦品种、组织和氮条件的差异塑造了不同的染色质结构区域,特别是H3K27ac和H3K27me3标记。
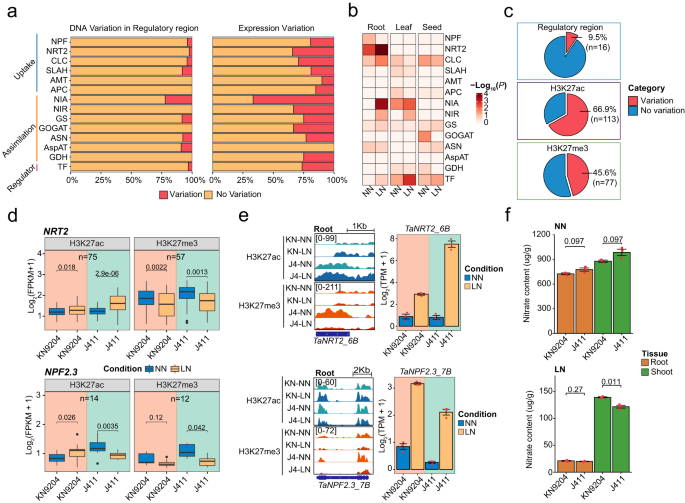
Fig1. KN9204和J411的染色质景观动态 2. NMGs品种偏性表达主要由组蛋白修饰变异介导 作者通过之前与其他六个植物物种(Brachypodium distachyon、Barley、Rice、Sorghum、Maize和Arabidopsis)的序列相似性比较,在小麦中总共鉴定了882个NMGs。研究发现,KN9204和J411之间有25%的NMGs表达水平不同(FDR < 0.05, Fold-change ≥1.5),而只有约5%的NMGs在调控区域(启动子区域的H3K27ac区域)存在DNA序列变异(fig.2a)。在不同组织中,NMGs的表达差异也存在(fig.2b)。大多数表现出品种偏移表达的NMGs被H3K27ac和H3K27me3的差异峰所标记(fig.2c,上端)。值得注意的是,作者观察到NRT2和NIA家族成员(约50%的基因具有动态H3K27ac和H3K27me3标记)同时受到H3K27ac和H3K27me3的调控。在根系中,NRT2家族在两个品种中在LN/NN条件下都显示了相似的H3K27ac和H3K27me3变化,但J411相比KN9204更为显著(fig.2d,上端)。例如,在TaNRT2_6A(TraesCS6A02G031000)位点,两个品种都对LN发生了H3K27ac增益和H3K27me3失能,但J411更为显著(fig.2e,上端)。这也与LN条件下J411的TaNRT2_6A诱导表达水平更高(fig.2e,上端)相符。TaNPF2.3参与 nitrite从根系到茎的运输,在KN9204中LN下H3K27me3降低,同时伴随着J411中H3K27ac显著降低(fig .2d,下端)。同样地,TaNPF2.3_7B在KN9204中对LN增加,但在J411中对LN/NN减少(fig .2e,下端)。此外,在LN条件下,KN9204的茎相对根中 nitrate含量更高,而不是NN条件(fig.2f)。因此,在低温胁迫条件下,KN9204种子的蛋白质含量较高。综上所述,不同水平的H3K27ac和H3K27me3与NMGs的表达偏移相关,导致KN9204和J411的氮代谢过程不同。
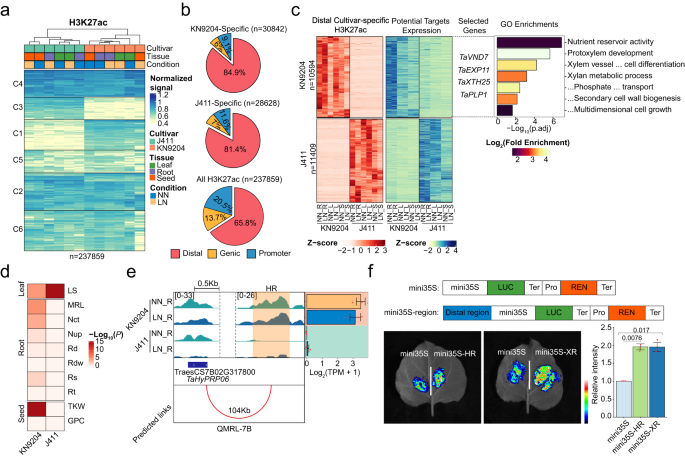
Fig2. 表观基因组变异对NMGs表达偏移的影响 3. 品种特异性H3K27ac通过转录调控影响氮利用相关性状 鉴于H3K27ac在调节LN/NN不同组织和品种中NMG的染色状态和表达模式方面的重要性,作者使用K-means聚类来识别品种特异性H3K27ac区域(fig.3a)。总的来说,品种特异性H3K27ac峰值主要出现在远端区域,而在启动子和基因区域中则较少出现(fig.3b)。此外,品种特异性H3K27ac标记的启动子与品种特异性表达的基因在根、叶和种子中密切相关(fig.3a,b)。例如,KN9204中的H3K27ac标记基因与细胞壁生物合成和营养储库活性有关,如脯氨酸转运蛋白1(PROT1)、侧器官边界域16(LBD16)、纤维素内切酶/酸化酶19(XTH19)、纤维素合成酶类似物5(CSLC5)等(fig .3c)。而在J411中,H3K27ac特别调节了花青素合成相关基因(fig.3c)。作者比较了不同品种小麦的H3K27ac标记,发现品种特定的远距离标记与H3K4me3和H2A.Z在同一基因组位置。在KN9204特定的远距离标记调控的靶基因中,富集于细胞壁合成、原xylem发育和养分储存活动等基因,其中一些基因已知与茎向养分运输有关。在J411特异性远端H3K27ac靶标中没有富集GO类别(fig.3c)。 转录本丰度的变化可以用于解析QTLs的基因基础,同时还可以研究基因编码区域的变异。在此研究中,作者探讨了品种特异性远端H3K27ac区域对KN9204-J411 RIL种群中QTLs中的DEGs的影响。在主要与NUE相关特征的QTLs中,KN9204特异性H3K27ac峰值调控的目标基因显著增多,这些精英基因决定因素来自于KN9204(Fig. 3d)。相反,受到J411特异性H3K27ac区域影响的基因则在与叶面积相关特征的QTLs中增多(Fig. 3d)。在KN9204中,与J411相比,TraesCS7B02G317800(杂合脯氨酸丰富蛋白质06,TaHyPRP06_7B)和TraesCS7B02G326900(TaXTH25_7B)等已知调控根发育的基因的表达水平显著升高。这种升高的表达与KN9204特异性H3K27ac远端调控区域的存在呈正相关(Fig.3e)。此外,通过荧光素酶报告基因测定检测技术确定了这些品种特异性调控区域的功能性潜力(Fig.3f,)。然而,由于小麦精确的3D基因组数据有限,这些品种特异性调控区域的功能潜力仍需进一步研究。因此,启动子和远端品种特异性H3K27ac区域在调节NUE相关性状的基因表达中都起着重要作用。
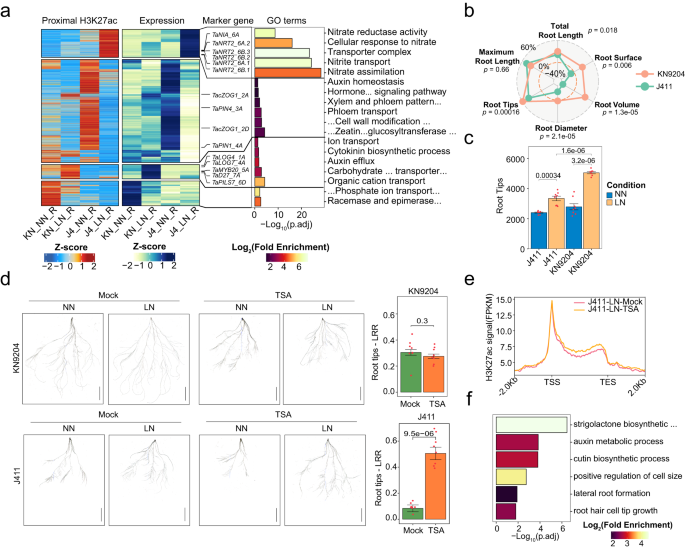
Fig3. 远端H3K27ac区差异影响KN9204和J411的 NUE相关性状变异 4. LN诱导的H3K27ac动态影响KN9204和J411不同的适应程序 作者进一步研究了 LN 对KN9204和J411的H3K27ac动态变化的作用,发现在LN/NN条件下,H3K27ac在KN9204和J411的不同组织中表现出不同的动态变化模式。KN9204在根系中表现出微弱的H3K27ac水平变化,而在叶片和种子中则表现出更显著的变化。而J411 在根系中表现出显著的丢失和较低的增加,但在地上组织中仅出现轻微的变化。研究发现,H3K27ac的动态变化导致KN9204和J411在根系中对LN的响应不同(fig.4a)。在LN/NN条件下,J411的近端区域(启动子和基因域)中H3K27ac的缺失导致auxin稳态、细胞分裂素代谢和激素信号调节等基因的表达下调(fig.4a)。而H3K27ac的增加与nitrate吸收、转运和同化相关基因的激活有关,包括TaNRT2和TaNIA(fig.4a)。相反,在KN9204的根系中,H3K27ac 的增加激活了参与细胞分裂素合成、auxin极性运输、糖类和有机阴离子转运的基因,如 DWARF27(TaD27)、PIN-LIKES 7(TaPILS7)和 LONELY GUY 4(TaLOG4)(fig.4a),这些基因在 LN 条件下促进根系生长。在 KN9204 的根系中,H3K27ac 的丢失导致参与磷酸离子转运的基因表达下调。在 LN 条件下,J411 的根系对LN的响应较低,表现为更多的根尖和更大的根直径,而在 KN9204 中,根系表面积和总根体积增加(fig.4b,c)。因此,LN引起的 H3K27ac 动态变化优先促进了 KN9204 的根系生长,同时加强了J411根系中的氮吸收系统。 在 LN/NN 条件下观察到的KN9204 和 J411 的根形态变化是否归因于品种特异性H3K27ac的改变?为了解决这个问题,作者使用水培培养系统测试了曲古柳菌素(TSA)对小麦幼苗 H3K27ac 模式的影响。经过western blotting 确认后,发现 TSA处理在NN条件下抑制了根系生长。在 KN9204 中, TSA处理组和未处理组LN条件都诱导了根系生长,表现为根尖数量增加(Fig. 4d)。相比之下,正如预期一样,J411在模拟条件下没有表现出LN诱导的根系生长。但是,当与TSA联合处理时,J411侧根尖的数量显著增加了(Fig. 4d)。此外,作者的分析确定了J411中一些特定基因,在这些基因中,LN条件下H3K27ac的减少被TSA处理有效地抵消了(Fig. 4e)。这些基因是根系发育过程中不可或缺的一部分(Fig. 4f),并在 LN 条件下上调。这一结果强调了 TSA处理如何恢复这些基因的高表达水平,从而有助于增强 J411 在 LN 条件下的根系生长。综上所述,TSA处理有助于减轻LN诱导的J411中H3K27ac的大量损失,最终恢复J411对LN条件的根生长响应。
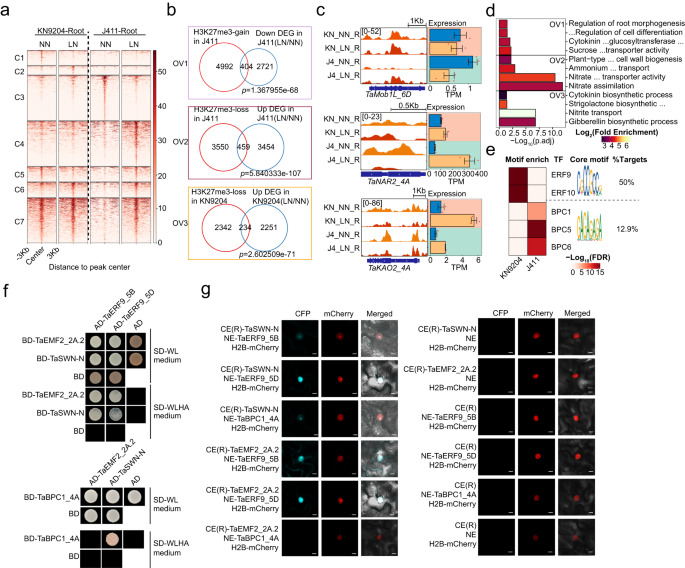
Fig4. H3K27ac动态揭示KN9204和J411对低氮条件的差异响应 5. LN处理下H3K27me3对KN9204和J411的根系发育具有不同的影响 在KN9204和J411中,叶片中的H3K27me3发生了微妙变化,而在J411的根中有大量的差异H3K27me3区域,但在KN9204的籽粒中没有。进一步使用K-means聚类分析确定了LN条件下KN9204和J411根中的不同类别的动态H3K27me3区域(fig.5a)。在根系方面,与KN9204相比,J411在LN诱导下发生了显著变化(fig.5a)。此外,LN诱导的H3K27me3增加的基因(fig.5a中的C4、C5和C7簇)与J411下调的基因显著重叠(fig.5b,顶部)。这些基因在根系生长相关过程中富集,包括 auxin 生物合成、细胞分化调节和根系形态发生(fig.5d,顶部)。例如,参与根发育的 Mob1 类转录因子基因在 LN 条件下在J411中增加了H3K27me3,而表达水平降低,而在 KN9204 中无显著变化(fig.5c,顶部)。反之,KN9204 中的H3K27me3增加仅与LN下调24个基因重叠,表明LN诱导的H3K27me3增加在J411中可能主要减少根生长过程,但在KN9204中影响较小。KN9204和J411中H3K27me3缺失的基因与响应LN、硝基转移和硝酸盐同化的基因显著重叠(fig.5b,中部和底部)。在J411中,参与硝基转移和SL、GA生物合成过程以及初级细胞壁发生相关基因的基因富集;而在KN9204中,参与硝酸盐运输和初级细胞壁发生相关基因的基因富集(fig.5d,中部和底部)。例如,TaNRT3.1_4A和ENT-KAURENOIC ACID HYDROXYLASE 2(TaKAO2_4A)的表达分别在J411和KN9204中激活,伴随着H3K27me3的降低(fig.5c,中部和底部)。因此,LN诱导的H3K27me3缺失在KN9204中倾向于激活根生长。反之,在J411中,H3K27me3的缺失激活了硝基吸收和代谢。 植物中H3K27me3的分布取决于不同DNA识别因子招募的复合物2(PRC2)的招募。为了深入了解两种不同植物品种KN9204和J411中动态H3K27me3景观的形成驱动力,作者对特定的motif进行了扫描和富集分析。该研究揭示了KN9204和J411中特定motif的出现差异,特别是占50%的“CGCCGCC”motif和占12.9%的“GAGAGA”重复)(fig.5e)。值得注意的是,这些motif也在拟南芥中的复合物响应元件(PRE)片段中出现。基于其他物种中对TF-DNA识别,作者选择了ERF域蛋白9(TaERF9_5B/ TaERF9_5D)和基本组氨酸1(TaBPC1_4A)作为潜在的PRC2招募者进行验证。有趣的是,在KN9204和J411中,TaERF9对LN条件的反应存在差异表达模式。具体来说,在LN条件下,TaERF9在KN9204中诱导程度更高(fig.5a,b)。另一方面,在LN条件下,TaBPC1在J411中的表达水平高于KN9204(fig.5c)。此外,作者在TaERF9_5A的转录本中发现了一个单核苷酸多态性(SNP),导致KN9204和J411之间发生了氨基酸替代(赖氨酸-谷氨酸)(fig.5d)。利用Y2H和双分子荧光互补(BiFC)实验,验证了TaERF9_5B/TaERF9_5D(AP2/ERF家族)可以与TaEMF2和TaSWN(PRC2的亚单位)相互作用(fig.5f,g)。重要的是,作者发现TaBPC1_4A可以与TaSWN相互作用(图5f,g,图5e,f),这与之前在拟南芥中的研究一致。因此,不同的转录因子可能通过LN诱导的差异化H3K27me3变化在KN9204和J411之间发挥作用,导致不同的根响应。
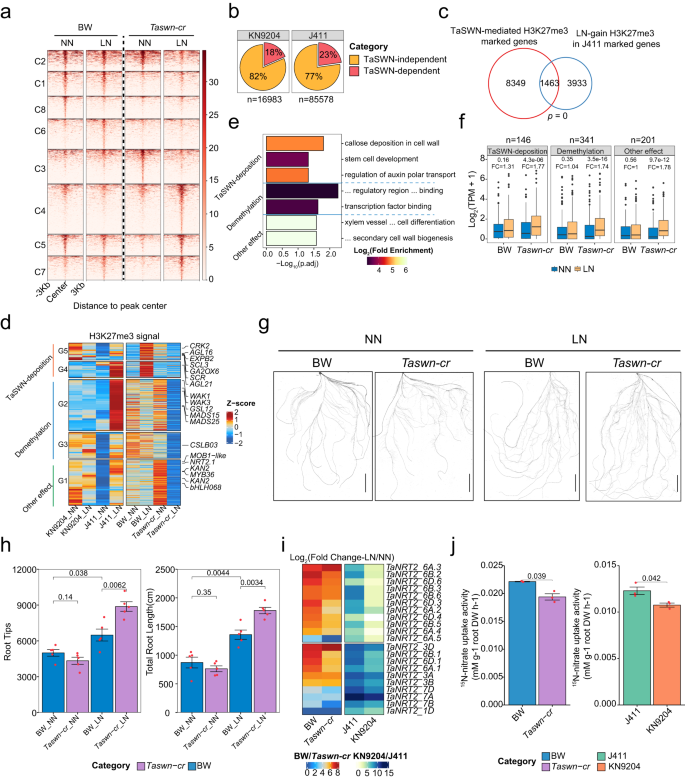
Fig5.H3K27me3模式的不同趋势决定了KN9204和J411对LN的不同适应 6. H3K27me3重新布线调节响应低氮的根系发育和硝酸盐吸收 作者探究了H3K27me3在低氮条件下对根系发育的重要作用。通过对三个三联体中编码H3K27me3甲基转移酶的9个基因在不同类型氮条件下在根中的表达分析,发现这些基因在不同氮条件下的表达存在差异。考虑到TaSWN在根中的高表达和转化效率较低,研究者使用CRISPR-Cas9系统在“Bobwhite”(BW)基础上创建了TaSWN全基因组三倍体敲除突变体。转基因小麦测序鉴定出TaSWN-cr纯合子系,TaSWN的三个亚基因组拷贝都发生移码突变。然后使用CUT&Tag技术比较了TaSWN-cr和BW的基因组广泛H3K27me3模式。结果表明,与BW相比,TaSWN-cr的H3K27me3峰值数量和长度显著减少,编码基因上的H3K27me3强度也降低。因此,该研究得出结论:TaSWN在小麦的某些基因组区域确实是H3K27me3的写入者。 随后,作者分析了BW和TaSWN-cr中的H3K27me3模式,以了解在LN条件下TaSWN如何影响它们。K-means聚类在NN或LN条件下识别出BW和TaSWN-cr中不同类别的动态H3K27me3区域(fig.6a)。无论在LN还是NN条件下,C1、C2、C6和C8簇与BW相比TaSWN-cr中的H3K27me3都减少了(fig.6a),表明TaSWN依赖性。作者还发现,在KN9204和J411中,大约18%-23%的LN诱导的H3K27me3峰受到TaSWN的影响(fig.6b)。与KN9204 (n = 155)相比,J411受SWN影响的基因较多(n = 1463),说明H3K27me3调控在J411中更为显著(fig.6c,)。进一步分析发现,TaSWN直接参与了J411中一些基因的H3K27me3变化,这些基因与植物根系发育有关,包括激素运输、干细胞发育和根形形成等方面(fig.6d, e)。此外,所有受到影响的基因在LN条件下在TaSWN缺失的TaSWN-cr中表达水平都有所升高,而在BW中则没有变化,这也与H3K27me3的降低相一致(fig.6f)。综上所述,在J411中,TaSWN在LN条件下参与了植物中H3K27me3的变化,从而影响了植物根系的发育。 因此作者推测LN处理可以促进BW和TaSWN-cr两种品种的生长,但两种品种的响应不同。具体来说,TaSWN-cr植物对LN的响应比BW更敏感,表现为LN条件下更发达的根系(fig.6g, h, i)。通过15N吸收试验发现这种对LN的响应差异可能是由于两种品种中NRT2基因表达水平和nitrate吸收速率的差异导致的(fig.6j)。比较低氮(LN)下BW和TaSWN-cr的根形态变化、nitrate吸收速率和转录组表达谱,发现 H3K27me3 在LN限制下平衡根生长和氮代谢中发挥重要作用。通过重新调整H3K27me3,可以影响小麦品种在适应低氮环境中的决策,即增强根生长或加强氮吸收系统。
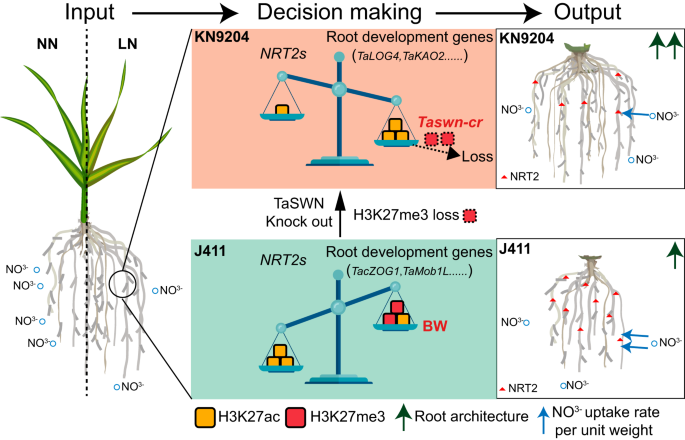
Fig6.通过H3K27me3重新布线增强LN的根适应性 本文研究了两种不同氮利用效率的小麦品种(KN9204和J411)在不同氮条件下的染色质表观遗传特征,发现氮代谢基因的表达与组蛋白修饰差异密切相关。表观遗传修饰表现出明显的品种特异性,可能为不同的农艺性状提供支持。此外,低氮(LN)可以诱导H3K27ac和H3K27me3在KN9204中显著增强根系生长,而在J411中则显著诱导NRT2。通过组蛋白去乙酰化酶抑制剂处理和敲除H3K27me3甲基转移酶TaSWN的转基因植株的证据表明,氮缺乏响应中表观遗传修饰的变化可以改变根系发展和氮吸收的策略偏好。本文展示了表观遗传学调节在调节小麦品种特异性适应LN中的重要性。这些结果为优化作物氮吸收效率和产量提供了重要的遗传基础。
Fig7.小麦表观遗传调控平衡对低氮多样性适应的模型 爱基百客专注于提供领先的表观组学技术服务。CUT&Tag是检测靶蛋白和DNA互作的新方法,拥有背景低、信号强,步骤简单,细胞起始量低,重复性好等优势。常用于研究组蛋白修饰和转录因子研究。爱基百客具有丰富的CUT&Tag项目经验,包括人(乳腺癌、肠癌、肾等)、小鼠、猪、蜜蜂、水稻、大豆、拟南芥、白菜、白叶枯病菌等50+物种经验,不同组织类型(胚胎、肾、卵巢、子宫、脑、甲状腺、胰腺、脾脏、淋巴结和肝等组织类型)均具有相关经验;可提供前期方案设计、测序、分析以及后期验证一站式服务。
项目咨询 了 解 更 多 { 往 期 精 彩 回 顾 } 精选合集,欢迎收藏哟! |